Denne artikkelen er en del av vår spesielle mai 2020 -utgave. Last ned hele utgaven her.
Forhold
Catinean A, Neag AM, Nita A, Buzea M, Buzoianu AD.Bacillusspp. Spores - Et lovende behandlingsalternativ for pasienter med irritabelt tarmsyndrom.Næringsstoffer. 2019; 11 (9): 1968.
Objektiv
Målet med denne studien var å sammenligne rifaximin etterfulgt av et ernæringsmessig eller lav gjærbart oligosakkarid, disakkarid, monosakkarid og polyol (FODMAP) kosthold med sporbasert probiotisk (megasporebiotisk) terapi alene hos pasienter med irritabelt avføring (Megasporebiotic).
Utkast
En ikke-blindet, prospektiv, randomisert, kontrollert klinisk studie. Deltakerne ble randomisert i 3 grupper:
- G1, bei dem die Teilnehmer eine 10-tägige Kur mit Rifaximin (1.200 mg) erhielten, gefolgt von einer 24-tägigen Kur mit einem nutrazeutischen Inhaltsstoff Bifidobacterium longum W11, lösliche Ballaststoffe und Vitamine B1B2B6und B12.
- G2, bei dem die Teilnehmer einen 34-tägigen Kurs erhielten Bazillus spp probiotisch (Bacillus licheniformis, Bacillus indicus HU36™, Bacillus subtilis HU58™, Bacillus clausii, Bacillus coagulansalle von der Marke MegaSporeBiotic).
- G3, bei dem die Teilnehmer eine 10-tägige Behandlung mit Rifaximin (1.200 mg) erhielten, gefolgt von einer 24-tägigen Low-FODMAP-Diät.
Forskere oppnådde utfallsmål ved baseline, dag 10 (for grupper G1 og G3), dag 34 og dag 60.
Deltager
Denne studien inkluderte 90 pasienter med irritabelt tarmsyndrom uten forstoppelse basert på Roma III -kriteriene. Pasientene var mellom 18 og 75 år gamle og hadde en normal koloskopi de siste 5 årene, blodverdier innenfor referanseverdier og normalt fekal calprotectin. Pasienter med dokumentert matallergier, glutenintoleranse eller cøliaki, diabetes, skjoldbruskkjertelsykdom, inflammatorisk tarmsykdom eller andre organiske sykdommer, spiseforstyrrelser (anoreksi eller bulimi), probiotika 1 måned før studien, antibiotikabehandling de siste 6 månedene, eller spesifikke dietter ble ekskludert.
Studieparametere vurdert
Forskere evaluerte pasienter basert på IBS Severity Score (IBS-SS), livskvalitet for IBS-pasienter (IBS-QL) og en rektal volumsensasjonstest.
Nøkkelinnsikt
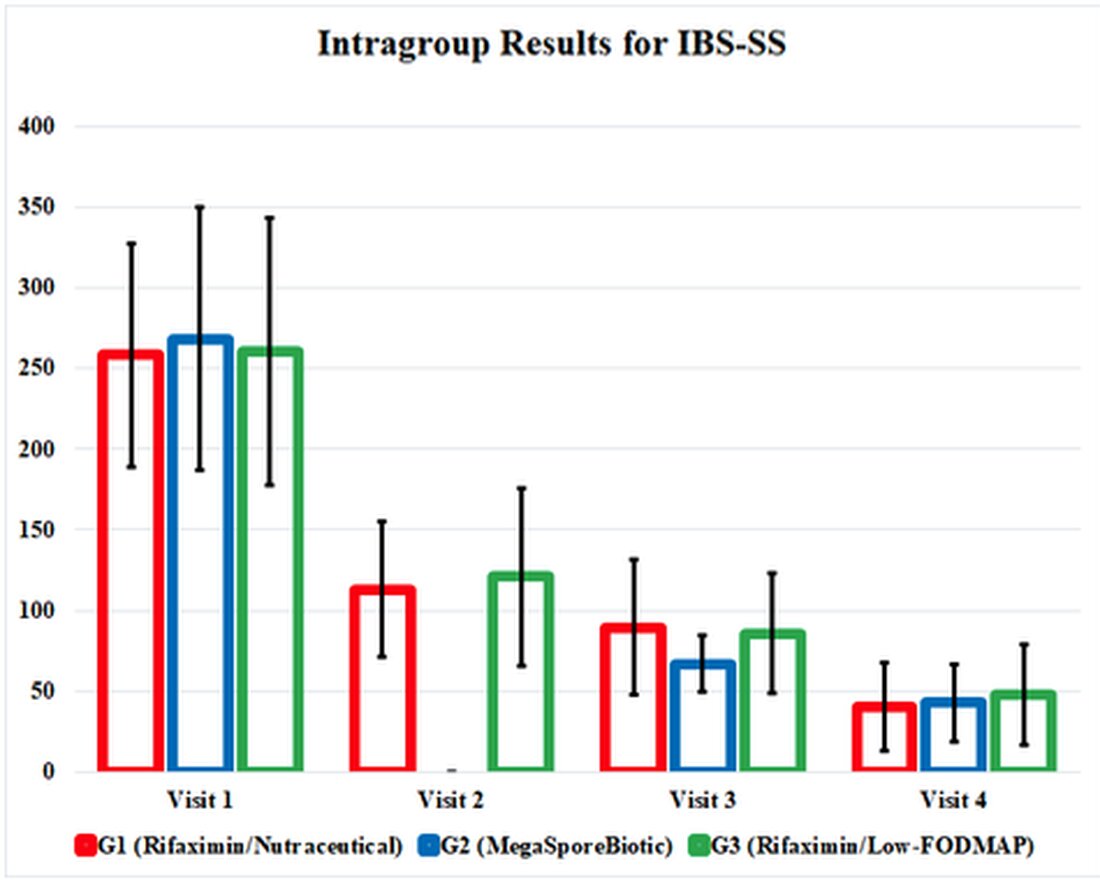
IBS-SS forbedret hvert utfallsmål for G1, G2 og G3 og forbedret interessant seg likt ved slutten av studien. Den megasporebiotiske gruppen, G2, hadde tidligere symptomforbedring ved besøk 3 (dag 34). Livskvalitet og score og rectal -volumsensasjonstest forbedret seg også i hver gruppe, med lignende resultater i hver gruppe.
Øv implikasjoner
Irritabelt tarmsyndrom er en vanlig lidelse som påvirker omtrent 10% av befolkningen, med betydelige hull i pålitelige og kostnadseffektive behandlingsstrategier.1Vår forståelse av patofysiologi utvides raskt ved bruk av systemisk biologi. Den for tiden foreslåtte modellen er et komplekst nett av tarmmikrobiota-dysfunksjon, endret tarmpermeabilitet, endret bevegelighet, gastrointestinal (GI) immuncelleaktivering, visceral overfølsomhet og unormale tarm-hjerne-interaksjoner.2Rifaximin dukket først opp som et effektivt behandlingsalternativ for å endre GI -mikrobiota i 2011 med målforsøket, noe som til slutt førte til FDA -godkjenning av Rifaximin for behandling av IBS med diaré i 2015.3Denne studien tar sikte på å vise at ikke-antibiotikabehandling ved å endre mikrobiomet med et sporbasert probiotikum også kan være effektivt for behandling av IBS med diaré (IBS-D).
Et av de mest spennende aspektene ved denne studien er kostnadseffektiviteten til sporbaserte probiotika sammenlignet med rifaximin.
Denne studien inneholder flere signifikante begrensninger, hvorav mange forfatterne erkjenner. Disse inkluderer mangel på blending og placebo, moderat snarere enn alvorlige symptomer ved baseline, mangel på pustetesting for tynntarmsbakteriell gjengroing (SIBO), og bruk av Roma III i stedet for Roma IV -kriterier. Forskerne brukte Roma III fordi denne studien begynte før Roma IV, og forfatterne bemerker at 90% av deltakerne også oppfylte de nye kriteriene.
Det er ytterligere begrensninger som ikke er diskutert av forfatterne. Det første og kanskje viktigste er at rifaximinbehandlingsgruppen ble underbehandlet i både dose og varighet. Den for øyeblikket aksepterte doseringen av rifaximin for IBS-D er 550 mg 3 ganger daglig (1.650 mg total daglig dose) i 14 dager.4I denne studien ble totalt 1200 mg per dag brukt i 10 dager, noe som er 52% av den effektive dosen. Dette fører til en betydelig resultatskjevhet sammenlignet med den sporbaserte probiotiske intervensjonen.
Forbedrede utfallstiltak kan styrke denne studien. Først brukte forfatterne en sensasjonstest for rektal volum ved baseline og ved hvert besøk. Denne testen er invasiv, upraktisk og har liten støtte i litteraturen som et resultatmål for IBS-D.5I stedet for rectal volumsensasjonstesten, vil en ikke-invasiv 3-timers laktulosepustetest forbedre studiedesignet. Dette ville ha gjort det mulig for forfatterne å inkludere bare pasienter med SIBO eller å stratifisere respondenter i hver behandlingsgruppe basert på SIBO -status. Rezaie et al. fant at pasienter med en positiv laktulosepustetest for SIBO reagerte betydelig bedre på rifaximinbehandling enn IBS-D-pasienter med en normal pustetest.6Inkludering av en 3-timers laktulosepustetest i denne studien ville ha avklart hvilke pasienter som var de beste kandidatene for sporbasert probiotisk behandling kontra rifaximinbehandling.
Bruken av 2 behandlingsgrupper (Rifaximin/Low-FODMAP-kosthold kontra sporbasert probiotisk) eller 2 behandlingsgrupper, og en placebogruppe ville ha forbedret klarheten i resultatene. Blending kan eliminere en annen kilde til skjevhet; Imidlertid er det umulig å blinde terapeutisk ernæring til vanlig ernæring, og dette er en kontinuerlig utfordring innen ernæringsforskning.
Effektene av de terapeutiske intervensjonene i denne studien ble begravet i forvirrende og tungvint tabeller, så jeg har fremhevet positive resultater i en grafisk som illustrerer studiens resultater. Denne grafikken presenterer studieresultatene og viser oss hvor effektive disse terapiene blir sammenlignet med hverandre. Det fremhever også det faktum at alle de tre behandlingsgruppene fortsatte å forbedre seg selv etter at intervensjoner ble avviklet ved besøk 3 (dag 34).
Et av de mest spennende aspektene ved denne studien er kostnadseffektiviteten til sporbaserte probiotika sammenlignet med rifaximin. Rifaximin -dosen som ble brukt i denne studien koster omtrent 1.300 dollar, og den anbefalte dosen er nærmere $ 2000. Forsikringsdekning krever ofte flere medisineringssvikt og tidligere autorisasjoner hvis behandlingen i det hele tatt dekkes. Dosen og varigheten av den sporbaserte probiotikum som ble brukt i denne studien, koster $ 55. Dette representerer en betydelig fordel med sporbasert probiotisk terapi. Forfatterne rapporterte ingen bivirkninger eller frafall, så det er vanskelig å faktorere disse faktorene i et kostnadseffektivitetsforhold.
Det skal også bemerkes at resultatene var like for sporbasert probiotikaps sammenlignet med den lave FODMAP-kostholdsbehandlingsgruppen. Lav-fodmap-dietten har vist seg å være en effektiv ernæringsstrategi for behandling av IBS-D.7Selv om det er spennende å ha et effektivt ernæringsverktøy for IBS, er dette kostholdet veldig restriktivt og har vidtrekkende psykososiale og ernæringsmessige effekter.8Etter min erfaring er det lave FODMAP -kostholdet et mer stressende kosthold sammenlignet med andre, kanskje enda mer restriktive dietter fordi matvalgene ikke er intuitive. Pasienter må kontinuerlig bruke utdelinger og apper og må derfor bli veldig årvåken for å følge dette kostholdet. I denne forbindelse gir sporbasert probiotisk terapi en betydelig fordel.
Konklusjon
Selv om denne studien har flere metodologiske problemer som introduserer skjevhet, er det viktig å erkjenne at resultatene av denne studien forbedrer vår forståelse av behandlingsalternativer for IBS-D. Sporebasert probiotisk terapi som en frittstående terapi var assosiert med forbedringer i IBS-alvorlighetsgrad, livskvalitet og rektalt volumsensasjon som tilsvarer de av rifaximin-terapi etterfulgt av et lite fodmap diett eller probiotikapo. Symptomene fortsatte å forbedre seg for alle 3 intervensjoner etter seponering av behandlingen, noe som fremgår av forbedrede IBS -alvorlighetsgrad på dag 60 sammenlignet med dag 34 etter seponering av behandlingen. Den viktigste feilen i studien var den utilstrekkelige dosen av rifaximin for behandling. Likevel tilbyr sporbasert probiotikapsa en mye enklere behandling til under 5% av kostnadene for rifaximin. Mer forskning er nødvendig før sporebasert probiotikapsa kan hevdes å være like effektiv som rifaximin, men det kan absolutt vurderes når du velger behandlingsalternativer for IBS-D-pasienter.

 Suche
Suche
 Mein Konto
Mein Konto