Dit artikel maakt deel uit van ons speciale nummer van mei 2020. Download hier het volledige nummer.
Relatie
Catinean A, Neag AM, Nita A, Buzea M, Buzoianu AD.bacilspp. Sporen – een veelbelovende behandelingsoptie voor patiënten met het prikkelbaredarmsyndroom.Voedingsstoffen. 2019;11(9):1968.
Objectief
Het doel van deze studie was om rifaximin gevolgd door een nutraceutisch of laag fermenteerbaar oligosacharide, disacharide, monosacharide en polyol (FODMAP) dieet te vergelijken met op sporen gebaseerde probiotische (MegaSporeBiotic) therapie alleen bij patiënten met het prikkelbare darm syndroom (IBS) zonder constipatie.
Voorlopige versie
Een niet-geblindeerde, prospectieve, gerandomiseerde, gecontroleerde klinische studie. Deelnemers werden gerandomiseerd in 3 groepen:
- G1, bei dem die Teilnehmer eine 10-tägige Kur mit Rifaximin (1.200 mg) erhielten, gefolgt von einer 24-tägigen Kur mit einem nutrazeutischen Inhaltsstoff Bifidobacterium longum W11, lösliche Ballaststoffe und Vitamine B1B2B6und B12.
- G2, bei dem die Teilnehmer einen 34-tägigen Kurs erhielten Bazillus spp probiotisch (Bacillus licheniformis, Bacillus indicus HU36™, Bacillus subtilis HU58™, Bacillus clausii, Bacillus coagulansalle von der Marke MegaSporeBiotic).
- G3, bei dem die Teilnehmer eine 10-tägige Behandlung mit Rifaximin (1.200 mg) erhielten, gefolgt von einer 24-tägigen Low-FODMAP-Diät.
Onderzoekers verkregen uitkomstmaten bij aanvang, dag 10 (voor groepen G1 en G3), dag 34 en dag 60.
Deelnemer
Deze studie omvatte 90 patiënten met het prikkelbaredarmsyndroom zonder constipatie op basis van de Rome III-criteria. Patiënten waren tussen de 18 en 75 jaar oud en hadden de afgelopen 5 jaar een normale colonoscopie, bloedwaarden binnen referentiewaarden en normaal fecaal calprotectine. Patiënten met gedocumenteerde voedselallergieën, glutenintolerantie of coeliakie, diabetes, schildklieraandoeningen, inflammatoire darmziekten of andere organische ziekten, eetstoornissen (anorexia of boulimia), probiotica 1 maand vóór het onderzoek, antibioticabehandeling in de afgelopen 6 maanden of specifieke diëten werden uitgesloten.
Studieparameters beoordeeld
Onderzoekers evalueerden patiënten op basis van de IBS-ernstscore (IBS-SS), de kwaliteit van leven voor PDS-patiënten (IBS-QL) en een rectale volumesensatietest.
Belangrijkste inzichten
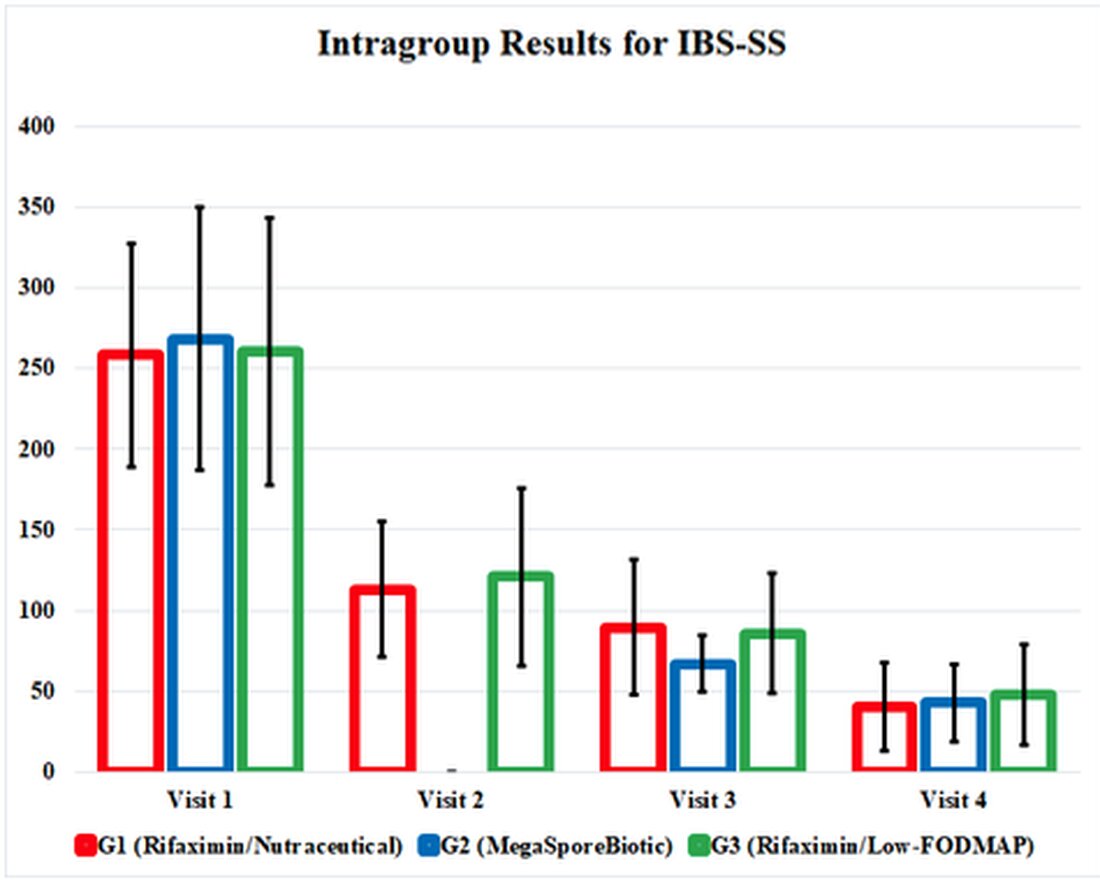
IBS-SS verbeterde op elke uitkomstmaat voor G1, G2 en G3 en, interessant genoeg, verbeterde in gelijke mate aan het einde van het onderzoek. De MegaSporeBiotic-groep, G2, had eerdere symptoomverbetering bij bezoek 3 (dag 34). De scores voor de kwaliteit van leven en de rectale volumesensatietest verbeterden ook in elke groep, met vergelijkbare resultaten in elke groep.
Oefen implicaties
Het prikkelbaredarmsyndroom is een veel voorkomende aandoening die ongeveer 10% van de bevolking treft, met aanzienlijke hiaten in betrouwbare en kosteneffectieve behandelstrategieën.1Ons begrip van pathofysiologie breidt zich snel uit met behulp van systemische biologie. Het momenteel voorgestelde model is een complex web van disfunctie van de darmmicrobiota, veranderde darmpermeabiliteit, veranderde motiliteit, gastro-intestinale (GI) immuuncelactivatie, viscerale overgevoeligheid en abnormale darm-herseninteracties.2Rifaximin kwam voor het eerst naar voren als een effectieve behandelingsoptie voor het veranderen van de gastro-intestinale microbiota in 2011 met de TARGET-studie, die uiteindelijk leidde tot goedkeuring door de FDA van rifaximin voor de behandeling van PDS met diarree in 2015.3Deze studie heeft tot doel aan te tonen dat niet-antibiotische therapie door het microbioom te veranderen met een op sporen gebaseerd probioticum ook effectief kan zijn voor de behandeling van PDS met diarree (IBS-D).
Een van de meest opwindende aspecten van deze studie is de kosteneffectiviteit van op sporen gebaseerde probiotica in vergelijking met rifaximin.
Deze studie bevat verschillende significante beperkingen, waarvan de auteurs er vele erkennen. Deze omvatten een gebrek aan blindering en placebo, matige in plaats van ernstige symptomen bij aanvang, een gebrek aan ademtests voor bacteriële overgroei in de dunne darm (SIBO) en het gebruik van Rome III in plaats van Rome IV-criteria. De onderzoekers gebruikten Rome III omdat deze studie vóór Rome IV begon, en de auteurs merken op dat 90% van de deelnemers ook aan de nieuwe criteria voldeed.
Er zijn aanvullende beperkingen die niet door de auteurs zijn besproken. De eerste en misschien wel belangrijkste is dat de groep die met rifaximin werd behandeld, zowel qua dosering als qua duur onderbehandeld was. De momenteel algemeen aanvaarde dosering van rifaximin voor PDS-D is 550 mg driemaal daags (1.650 mg totale dagelijkse dosis) gedurende 14 dagen.4In dit onderzoek werd gedurende 10 dagen in totaal 1.200 mg per dag gebruikt, wat 52% van de effectieve dosis is. Dit leidt tot een significante resultaatvertekening vergeleken met de op sporen gebaseerde probiotische interventie.
Verbeterde uitkomstmaten zouden dit onderzoek kunnen versterken. Ten eerste gebruikten de auteurs een rectale volumesensatietest bij aanvang en bij elk bezoek. Deze test is invasief, lastig en vindt in de literatuur weinig steun als uitkomstmaat voor PDS-D.5In plaats van de rectale volumesensatietest zou een niet-invasieve lactulose-ademtest van 3 uur het onderzoeksontwerp verbeteren. Dit zou de auteurs in staat hebben gesteld alleen patiënten met SIBO op te nemen of de responders in elke behandelingsgroep te stratificeren op basis van de SIBO-status. Rezaie et al. ontdekte dat patiënten met een positieve lactulose-ademtest voor SIBO significant beter reageerden op rifaximin-therapie dan PDS-D-patiënten met een normale ademtest.6Het opnemen van een 3 uur durende lactulose-ademtest in deze studie zou duidelijk hebben gemaakt welke patiënten de beste kandidaten waren voor op sporen gebaseerde probiotische behandeling versus rifaximin-therapie.
Het gebruik van 2 behandelgroepen (rifaximin/low-FODMAP-dieet versus op sporen gebaseerd probioticum) of 2 behandelgroepen en een placebogroep zou de duidelijkheid van de resultaten hebben verbeterd. Blindering zou een andere bron van vooringenomenheid kunnen elimineren; Het is echter onmogelijk om therapeutische voeding te koppelen aan de gebruikelijke voeding en dit is een voortdurende uitdaging in het voedingsonderzoek.
De effecten van de therapeutische interventies in dit onderzoek waren verborgen in verwarrende en omslachtige tabellen. Daarom heb ik de positieve resultaten uitgelicht in een grafiek die de resultaten van het onderzoek illustreert. Deze grafiek presenteert de onderzoeksresultaten en laat ons zien hoe effectief deze therapieën met elkaar worden vergeleken. Het benadrukt ook het feit dat alle drie de behandelingsgroepen bleven verbeteren, zelfs nadat de interventies waren stopgezet bij bezoek 3 (dag 34).
Een van de meest opwindende aspecten van deze studie is de kosteneffectiviteit van op sporen gebaseerde probiotica in vergelijking met rifaximin. De dosis Rifaximin die in dit onderzoek werd gebruikt, kost ongeveer $ 1.300, en de aanbevolen dosis ligt dichter bij $ 2.000. Verzekeringsdekking vereist vaak meerdere medicijnmislukkingen en voorafgaande toestemming als de behandeling überhaupt wordt gedekt. De dosis en duur van het op sporen gebaseerde probioticum dat in dit onderzoek wordt gebruikt, kost $ 55. Dit vertegenwoordigt een aanzienlijk voordeel van op sporen gebaseerde probiotische therapie. De auteurs rapporteerden geen bijwerkingen of uitval van deelnemers, dus het is moeilijk om deze factoren in een kosteneffectiviteitsratio te verwerken.
Er moet ook worden opgemerkt dat de resultaten vergelijkbaar waren voor op sporen gebaseerde probiotische therapie in vergelijking met de behandelgroep met een laag FODMAP-dieet. Het is aangetoond dat het low-FODMAP-dieet een effectieve voedingsstrategie is voor de behandeling van PDS-D.7Hoewel het opwindend is om een effectief voedingsmiddel voor PDS te hebben, is dit dieet zeer restrictief en heeft het verreikende psychosociale en voedingseffecten.8In mijn ervaring is het low FODMAP-dieet een stressvoller dieet vergeleken met andere, misschien zelfs restrictievere diëten, omdat de voedselkeuzes niet intuïtief zijn. Patiënten moeten voortdurend hand-outs en apps gebruiken en moeten daarom zeer waakzaam worden om dit dieet succesvol te volgen. In dit opzicht biedt op sporen gebaseerde probiotische therapie een aanzienlijk voordeel.
Conclusie
Hoewel deze studie verschillende methodologische problemen kent die vooringenomenheid introduceren, is het belangrijk om te erkennen dat de resultaten van deze studie ons begrip van de behandelingsopties voor PDS-D verbeteren. Op sporen gebaseerde probiotische therapie als op zichzelf staande therapie ging gepaard met verbeteringen in de ernst van PDS, kwaliteit van leven en rectale volumesensatie gelijkwaardig aan die van rifaximin-therapie gevolgd door een laag-FODMAP-dieet of probiotische therapie. De symptomen bleven verbeteren voor alle drie de interventies na stopzetting van de behandeling, zoals blijkt uit verbeterde IBS-ernstscores op dag 60 vergeleken met dag 34 na stopzetting van de behandeling. De belangrijkste fout in het onderzoek was de onvoldoende dosis rifaximin voor de behandeling. Niettemin biedt op sporen gebaseerde probiotische therapie een veel eenvoudiger behandeling tegen minder dan 5% van de kosten van rifaximin. Er is meer onderzoek nodig voordat kan worden beweerd dat op sporen gebaseerde probiotische therapie even effectief is als rifaximin, maar het kan zeker worden overwogen bij het selecteren van behandelingsopties voor PDS-D-patiënten.

 Suche
Suche
 Mein Konto
Mein Konto