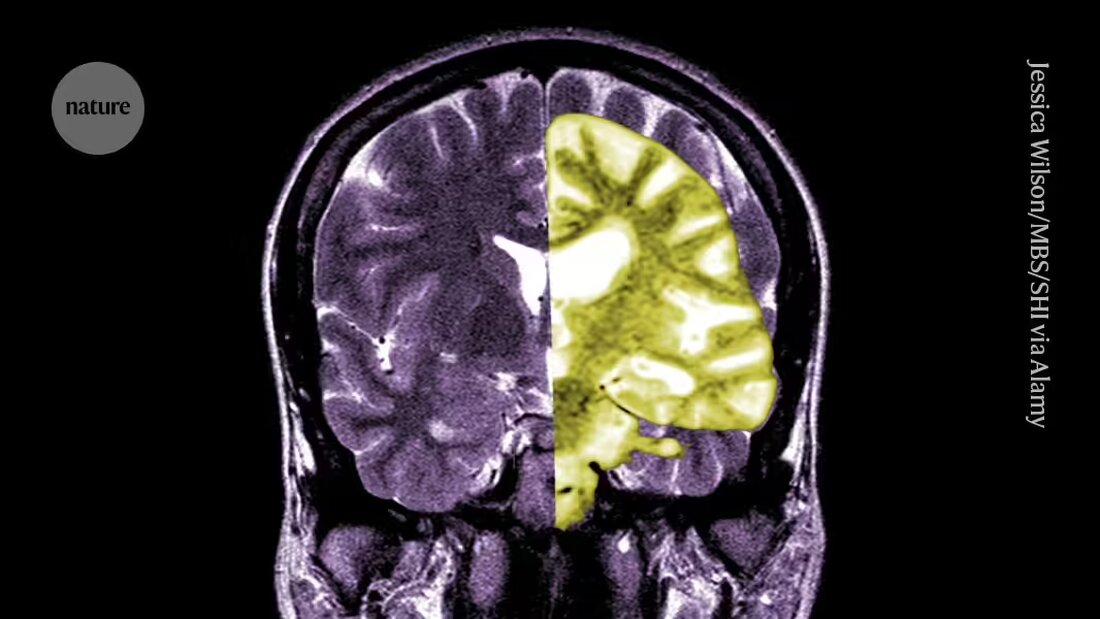
O debate sobre o lecanemab, medicamento para a doença de Alzheimer - um dos primeiros medicamentos a retardar o declínio cognitivo nas pessoas - está a intensificar-se entre investigadores e médicos sobre se os benefícios potenciais do tratamento superam os seus riscos.
Em 22 de agosto, a Agência Reguladora de Medicamentos e Produtos de Saúde da Grã-Bretanha deu luz verde ao medicamento. Ao mesmo tempo, porém, o regulador de saúde britânico NICE, que determina se os medicamentos são oferecidos aos pacientes no Serviço Nacional de Saúde (NHS) financiado pelo Estado britânico, disse num projecto que o lecanemab não seria disponibilizado no NHS porque os benefícios eram demasiado pequenos para justificar o elevado custo.
“O tempo invulgarmente longo que passaram a analisar o medicamento sugere que esta não foi uma decisão fácil ou simples”, disse o psiquiatra Robert Howard, da University College London, num comunicado ao Science Media Centre, no Reino Unido.
Os reguladores dos EUA foram os primeiros a aprovar o medicamento em 2023, e a Agência Europeia de Medicamentos (EMA) está agora a rever a sua decisão na sequência de um recurso da farmacêutica.
Alvo amilóide
A decisão da EMA também recebeu reações diversas da comunidade de Alzheimer. “As emoções estão realmente em alta aqui”, diz o bioquímico Christian Haass, da Universidade Ludwig Maximilians, em Munique, Alemanha, que discorda da decisão. “É o primeiro medicamento modificador de doenças que temos em mais de 30 anos.” Negar aos pacientes o acesso ao lecanemab significa que muitos perdem a oportunidade de ganhar um tempo valioso, de acordo com Haass.
Lecanemab, ou Leqembi, é um anticorpo monoclonal que elimina a amiloide, uma substância que se acumula em aglomerados tóxicos no cérebro de pessoas com Alzheimer. O medicamento, fabricado pela Eisai em Tóquio e pela Biogen em Cambridge, Massachusetts, também foi aprovado na China, Japão, Coreia do Sul e Emirados Árabes Unidos.
Outros aplaudem a EMA, dizendo que embora o medicamento tenha sido eficaz na redução dos níveis de amiloide no cérebro, ainda não está claro se a redução resultante no declínio cognitivo resultará em benefícios clinicamente relevantes para os pacientes. Eles afirmam que a possibilidade de complicações graves, como sangramento ou inchaço no cérebro, causadas por um efeito colateral denominado efeitos de imagem relacionados à amiloide (ARIA), embora pequeno, é uma grande preocupação. “Uma avaliação razoável dos riscos versus benefícios deste medicamento deve levar as pessoas a serem muito céticas”, diz Matthew Schrag, neurologista da Universidade Vanderbilt em Nashville, Tennessee.
Efeitos modestos
Há muito que se debate se o lecanemab administrado por perfusão proporciona às pessoas reduções clinicamente significativas no declínio cognitivo.
Um ensaio clínico de Fase III do medicamento, publicado em 2022, incluiu 1.795 pessoas nos estágios iniciais da doença de Alzheimer e descobriu que aqueles que receberam o medicamento apresentaram uma redução de 27% no declínio cognitivo após 18 meses em comparação com aqueles que receberam placebo. Alguns pesquisadores comemoraram a notícia como uma vitória da área. No entanto, outros argumentaram que os efeitos são demasiado pequenos para terem um impacto significativo nos pacientes.
Uma das razões para esta diferença de perspetiva é a forma como as pessoas olham para os dados, diz Sebastian Walsh, investigador de saúde pública da Universidade de Cambridge, no Reino Unido. A redução de 27% representa a diferença relativa na quantidade de declínio cognitivo experimentado pelo grupo do medicamento em comparação com o grupo do placebo. Contudo, a diferença absoluta na função cognitiva é muito menor: 0,45 pontos numa escala de 18 pontos. “As pessoas podem extrair o que quiserem do tamanho do efeito”, diz Walsh. “Se quiserem vender o medicamento, poderão concentrar-se nas mudanças relativas – e se forem muito cépticos, poderão falar sobre as diferenças absolutas”.
Mas mesmo os pequenos efeitos podem tornar-se significativos ao longo do tempo, particularmente nas fases posteriores da doença, quando a degradação ocorre mais rapidamente, diz Walsh. “Em última análise, depende da sua opinião sobre qual será o impacto a longo prazo, e não temos uma resposta para isso.”
Alguns dados de longo prazo estão agora disponíveis. Na Conferência Internacional da Associação de Alzheimer (AAIC), na Filadélfia, no mês passado, a Eisai e a Biogen apresentaram resultados de um estudo de extensão aberto que continuou a monitorar pacientes que receberam lecanemabe após a conclusão do estudo de Fase III. Após três anos de tratamento contínuo, mais da metade dos pacientes apresentaram melhora, e a maioria dos casos de ARIA ocorreu nos primeiros seis meses de tratamento. Eles também relataram que a taxa de declínio cognitivo retornou aos níveis do placebo quando as pessoas pararam de tomar o medicamento, mesmo que as placas amilóides tivessem sido removidas antes da interrupção do tratamento.
Alguns estão optimistas quanto a estes resultados - Haass diz que é emocionante ver que o medicamento não só elimina a amiloide, mas também retarda a propagação da tau, outra proteína que se acumula no cérebro das pessoas com Alzheimer. Outros são mais cautelosos. Paresh Malhotra, neurologista do Imperial College London, salienta que os resultados positivos apresentados na AAIC não foram comparados com um placebo, pelo que são necessários mais dados para determinar a eficácia do medicamento a longo prazo.
O custo também é uma preocupação. Walsh diz que, dados os efeitos modestos do medicamento, é difícil justificar o custo de administração do medicamento (que custa mais de 20 mil dólares por ano nos EUA) e os procedimentos necessários, tais como imagiologia e testes genéticos, para identificar pessoas elegíveis para o receber.
Preocupações de segurança
A maior preocupação com o lecanemab é o ARIA, sobre o qual a Food and Drug Administration (FDA) dos EUA alertou na sua aprovação. Embora a maioria dos casos sejam assintomáticos – e nenhum tenha sido notificado durante o ensaio clínico inicial de 18 meses – ocorreram algumas mortes relacionadas com ARIA na fase alargada do estudo.
Alguns especialistas dizem que embora o risco de ARIA grave seja baixo, também é importante considerar que o medicamento é administrado nas fases iniciais da doença de Alzheimer. “Este é o período em que as pessoas têm mais a perder”, diz Schrag. “Durante esse período, muitas vezes incentivamos os pacientes a viajar, pensar em sua lista de desejos e realizar as coisas que desejam na vida.”
Ellis van Etten, neurologista do Centro Médico da Universidade de Leiden, na Holanda, diz que ainda há muitas perguntas sem resposta sobre ARIA e como os médicos devem responder quando vêem pacientes desenvolvendo estas anomalias durante o tratamento. Por exemplo: Quem desenvolverá ARIA grave ou potencialmente fatal? Em que ponto o ARIA passa de inofensivo a prejudicial e quando o tratamento com lecanemab deve ser interrompido?
Muitas das mesmas questões sobre benefícios e riscos também se aplicam a outro anticorpo eliminador de amiloide, o donanemab – fabricado pela Eli Lilly em Indianápolis, Indiana – que foi aprovado pela FDA em julho. Donanemab parece proporcionar aproximadamente a mesma redução no declínio cognitivo que o lecanamab – e tem sido associado a mortes relacionadas com ARIA.
“Sabemos, através do trabalho com biomarcadores, que estes anticorpos eliminam a amiloide, por isso sabemos que abordam um mecanismo fundamental da doença”, diz Malhotra. Mas estes medicamentos por si só provavelmente não serão suficientes e será importante abordar também outros aspectos da doença. “É muito provável que dentro de 10 anos estaremos a falar de terapias combinadas e que a depuração da amiloide faça parte dessa abordagem.”

 Suche
Suche
 Mein Konto
Mein Konto