Le débat sur le médicament contre la maladie d'Alzheimer, lecanemab - l'un des premiers médicaments capables de ralentir le déclin cognitif chez l'homme - s'intensifie parmi les chercheurs et les cliniciens pour savoir si les avantages potentiels du traitement l'emportent sur ses risques.
Le 22 août, l'Agence britannique de réglementation des médicaments et des produits de santé a donné son feu vert au médicament. Dans le même temps, cependant, le régulateur britannique de la santé, le NICE, qui détermine si les médicaments sont proposés aux patients du National Health Service (NHS), financé par l'État britannique, a déclaré dans un projet que le lécanemab ne serait pas disponible sur le NHS parce que les bénéfices étaient trop faibles pour justifier son coût élevé.
"Le temps inhabituellement long qu'ils ont passé à examiner le médicament suggère que ce n'était pas une décision facile ou simple", a déclaré le psychiatre Robert Howard de l'University College de Londres dans une déclaration au Science Media Center en Grande-Bretagne.
Les régulateurs américains ont été les premiers à approuver le médicament en 2023, et l'Agence européenne des médicaments (EMA) réexamine actuellement sa décision suite à un appel du fabricant du médicament.
Cible amyloïde
La décision de l'EMA a également suscité des réactions mitigées de la part de la communauté Alzheimer. "Les émotions sont vraiment vives ici", déclare le biochimiste Christian Haass de l'Université Ludwig Maximilians de Munich, en Allemagne, qui n'est pas d'accord avec la décision. «C’est le premier médicament modificateur de la maladie que nous ayons depuis plus de 30 ans.» Selon Haass, refuser aux patients l’accès au lécanemab signifie que beaucoup perdent l’opportunité de gagner un temps précieux.
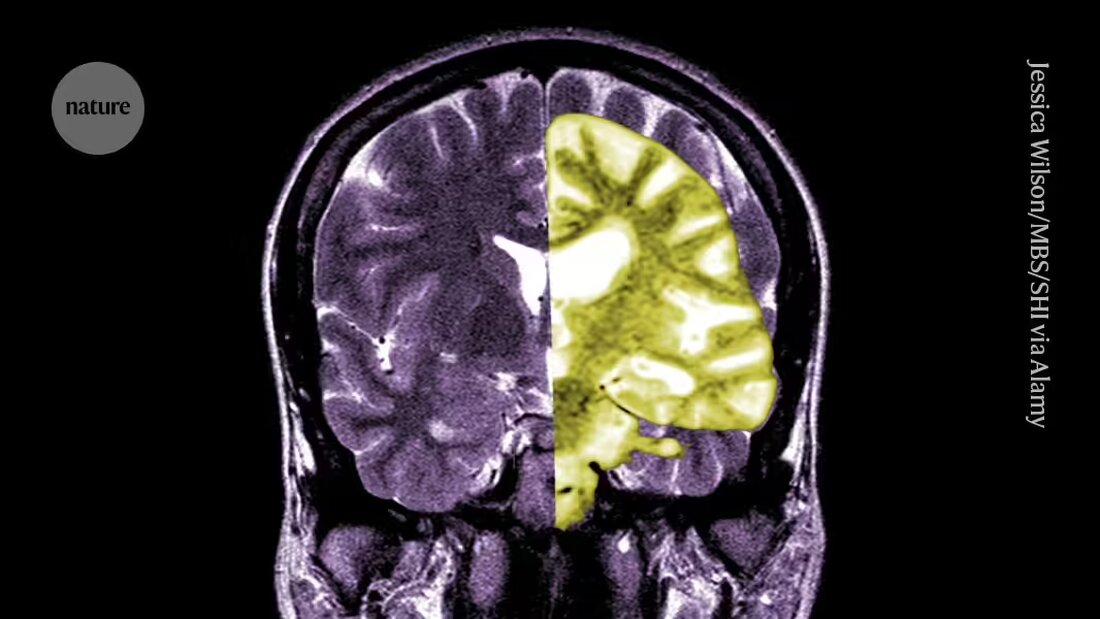
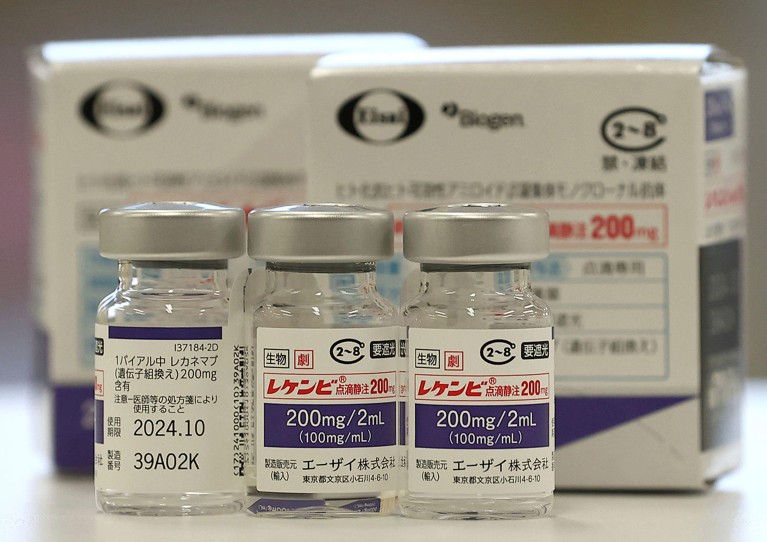
Le lécanemab, ou Leqembi, est un anticorps monoclonal qui élimine l'amyloïde, une substance qui s'accumule en amas toxiques dans le cerveau des personnes atteintes de la maladie d'Alzheimer. Le médicament, fabriqué par Eisai à Tokyo et Biogen à Cambridge, dans le Massachusetts, est également approuvé en Chine, au Japon, en Corée du Sud et aux Émirats arabes unis.
D'autres applaudissent l'EMA, affirmant que même si le médicament a été efficace pour réduire les niveaux d'amyloïde dans le cerveau, il reste à savoir si la réduction du déclin cognitif qui en résultera entraînera des bénéfices cliniquement pertinents pour les patients. Ils affirment que la possibilité de complications graves telles qu’un saignement ou un gonflement du cerveau provoqué par un effet secondaire appelé effets d’imagerie liés à l’amyloïde (ARIA), bien que minime, constitue une préoccupation majeure. "Une évaluation raisonnable des risques et des bénéfices de ce médicament devrait amener les gens à être très sceptiques", déclare Matthew Schrag, neurologue à l'Université Vanderbilt de Nashville, Tennessee.
Des effets modestes
La question de savoir si le lécanemab administré par perfusion permet aux patients de réduire de manière cliniquement significative le déclin cognitif a longtemps été débattue.
Un essai clinique de phase III du médicament, publié en 2022, a inclus 1 795 personnes aux premiers stades de la maladie d'Alzheimer et a révélé que celles qui avaient reçu le médicament présentaient une réduction de 27 % du déclin cognitif après 18 mois par rapport à celles qui avaient reçu un placebo. Certains chercheurs ont célébré la nouvelle comme une victoire pour le domaine. Cependant, d’autres ont fait valoir que les effets sont trop faibles pour avoir un impact significatif sur les patients.
L'une des raisons de cette différence de perspective réside dans la manière dont les gens examinent les données, explique Sebastian Walsh, chercheur en santé publique à l'Université de Cambridge, au Royaume-Uni. La réduction de 27 % représente la différence relative dans l’ampleur du déclin cognitif ressenti par le groupe médicamenteux par rapport au groupe placebo. Cependant, la différence absolue dans la fonction cognitive est bien moindre : 0,45 point sur une échelle de 18 points. "Les gens peuvent extraire ce qu'ils veulent de la taille de l'effet", explique Walsh. « S’ils veulent vendre le médicament, ils pourraient se concentrer sur les changements relatifs – et s’ils sont très sceptiques, ils pourraient parler des différences absolues. »
Mais même de petits effets peuvent devenir significatifs avec le temps, en particulier aux derniers stades de la maladie, lorsque la dégradation se produit plus rapidement, explique Walsh. "En fin de compte, cela dépend de ce que vous pensez de l'impact à long terme, et nous n'avons pas de réponse à cette question."
Certaines données à long terme sont désormais disponibles. Lors de la conférence internationale de l'Association Alzheimer (AAIC) à Philadelphie le mois dernier, Eisai et Biogen ont présenté les résultats d'une étude d'extension ouverte qui a continué à surveiller les patients ayant reçu du lécanemab après la fin de l'essai de phase III. Après trois ans de traitement continu, plus de la moitié des patients ont montré une amélioration et la plupart des cas d'ARIA sont survenus au cours des six premiers mois de traitement. Ils ont également rapporté que le taux de déclin cognitif revenait aux niveaux du placebo lorsque les personnes arrêtaient de prendre le médicament, même si les plaques amyloïdes avaient été retirées avant l'arrêt du traitement.
Certains sont optimistes quant à ces résultats. Haass dit qu'il est passionnant de voir que le médicament non seulement élimine l'amyloïde, mais ralentit également la propagation de la protéine tau, une autre protéine qui s'accumule en amas dans le cerveau des personnes atteintes de la maladie d'Alzheimer. D'autres sont plus prudents. Paresh Malhotra, neurologue à l'Imperial College de Londres, souligne que les résultats positifs présentés à l'AAIC n'ont pas été comparés à un placebo et que davantage de données sont donc nécessaires pour déterminer l'efficacité à long terme du médicament.
Le coût est également une préoccupation. Walsh dit qu'étant donné les effets modestes du médicament, il est difficile de justifier le coût d'administration du médicament (qui coûte plus de 20 000 dollars par an aux États-Unis) et les procédures requises, telles que l'imagerie et les tests génétiques, pour identifier les personnes éligibles pour le recevoir.
Problèmes de sécurité
Le plus grand problème concernant le lécanemab est l'ARIA, contre lequel la Food and Drug Administration (FDA) des États-Unis a mis en garde dans son approbation. Bien que la plupart des cas soient asymptomatiques - et aucun n'a été signalé au cours de l'essai clinique initial de 18 mois - des décès liés à l'ARIA ont été enregistrés au cours de la phase prolongée de l'étude.
Certains experts affirment que même si le risque d'ARIA grave est faible, il est également important de considérer que le médicament est administré dès les premiers stades de la maladie d'Alzheimer. «C'est la période pendant laquelle les gens ont le plus à perdre», explique Schrag. "Pendant cette période, nous encourageons souvent les patients à voyager, à réfléchir à leur liste de choses à faire et à accomplir les choses qu'ils souhaitent accomplir dans la vie."
Ellis van Etten, neurologue au centre médical de l'université de Leiden aux Pays-Bas, affirme qu'il reste encore de nombreuses questions sans réponse sur l'ARIA et sur la manière dont les médecins devraient réagir lorsqu'ils voient des patients développer ces anomalies pendant le traitement. Par exemple : Qui développera une ARIA grave ou potentiellement mortelle ? À quel moment ARIA passe-t-il d’inoffensif à nocif et quand doit-on arrêter le traitement par lecanemab ?
Bon nombre des mêmes questions sur les avantages et les risques s’appliquent également à un autre anticorps anti-amyloïde, le donanemab – fabriqué par Eli Lilly à Indianapolis, Indiana – qui a été approuvé par la FDA en juillet. Le donanemab semble entraîner à peu près la même réduction du déclin cognitif que le lécanamab – et il a été associé à des décès liés à l'ARIA.
"Nous savons grâce aux travaux sur les biomarqueurs que ces anticorps éliminent l'amyloïde, nous savons donc qu'ils s'attaquent à un mécanisme fondamental de la maladie", explique Malhotra. Mais ces médicaments à eux seuls ne suffiront probablement pas et il sera également important de s’attaquer à d’autres aspects de la maladie. « Il est très probable que dans 10 ans nous parlerons de thérapies combinées et que la clairance amyloïde fera partie de cette approche. »

 Suche
Suche
 Mein Konto
Mein Konto