L’intelligenza artificiale (AI) sta contribuendo a ridisegnare l’albero genealogico dei virus. Utilizzo delle strutture proteiche previste AlphaFold e quelli ispirati ai chatbot “Modelli del linguaggio proteico” hanno scoperto connessioni sorprendenti in una famiglia di virus che comprende agenti patogeni che infettano gli esseri umani e minacce emergenti.
Gran parte della comprensione degli scienziati riguardo evoluzione virale si basa sul confronto dei genomi. Tuttavia, la rapidissima evoluzione dei virus, in particolare quelli con genomi a RNA, e la loro propensione ad acquisire materiale genetico da altri organismi dimostra che le sequenze genetiche possono nascondere relazioni più profonde e distanti tra i virus, che possono variare a seconda del gene studiato.
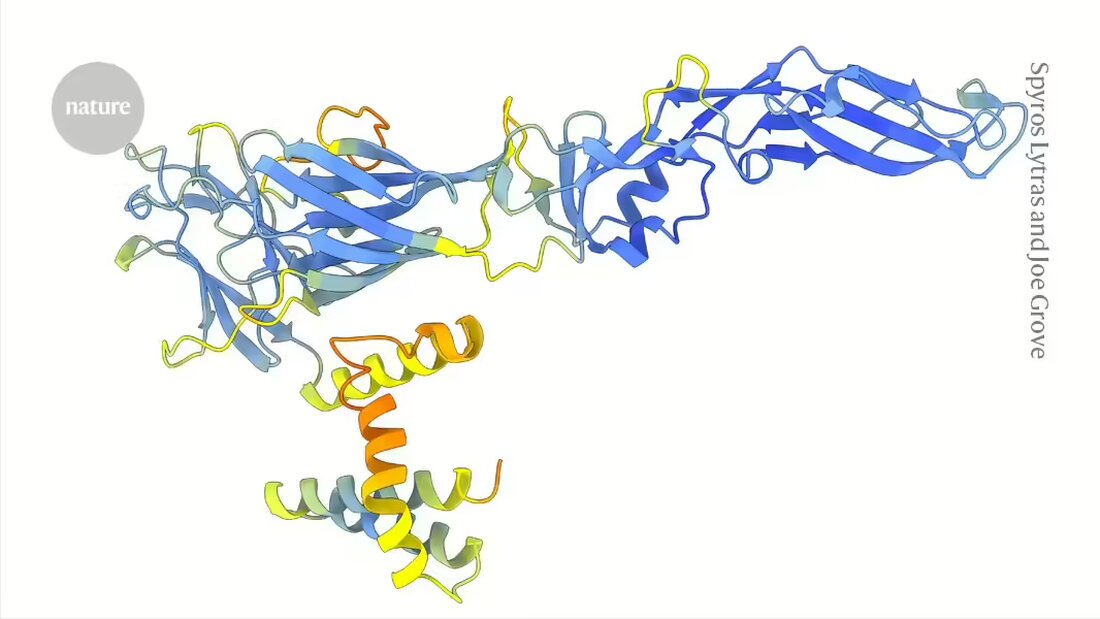
Al contrario, le forme o le strutture delle proteine codificate dai geni virali tendono a cambiare lentamente, rendendo possibile l’individuazione di queste connessioni evolutive nascoste. Tuttavia, fino all’avvento di strumenti come AlphaFold, in grado di prevedere le strutture proteiche su larga scala, non era possibile confrontare le strutture proteiche di un’intera famiglia di virus, afferma Joe Grove, virologo molecolare dell’Università di Glasgow, nel Regno Unito.
In un articolo pubblicato questa settimana suNatura 1Grove e il suo team dimostrano la potenza di un approccio basato sulla struttura dei flavivirus, un gruppo che comprende i virus dell’epatite C, della dengue e del virus Zika, nonché diversi importanti agenti patogeni e specie animali che potrebbero rappresentare minacce emergenti per la salute umana.
Come i virus invadono
La comprensione dei ricercatori dell'evoluzione dei flavivirus si basa principalmente su sequenze di enzimi a lenta evoluzione che copiano il loro materiale genetico. Tuttavia, si sa molto poco sulle origini delle proteine di “ingresso virale” che i flavivirus utilizzano per entrare nelle cellule e che determinano l’ospite che possono infettare. Grove sostiene che questa lacuna di conoscenze ostacolerà lo sviluppo di un vaccino efficace contro il virus Epatite C, che uccide centinaia di migliaia di persone ogni anno.
"A livello di sequenza, le cose sono così divergenti che non possiamo dire se siano correlate o meno", dice. “La svolta nella previsione della struttura delle proteine apre l’intera questione e possiamo vedere le cose abbastanza chiaramente”.
I ricercatori hanno utilizzato DeepMinds AlphaFold2 -modello e ESM Fold, a Struttura- Strumento di previsione sviluppato dal colosso tecnologico Meta, per generare più di 33.000 strutture previste per le proteine di 458 specie di flavivirus. ESMFold si basa su un modello linguistico addestrato con decine di milioni di sequenze proteiche. A differenza di AlphaFold, richiede solo una sequenza di input anziché fare affidamento su più sequenze di proteine simili, il che potrebbe renderlo particolarmente utile per studiare i virus più misteriosi.
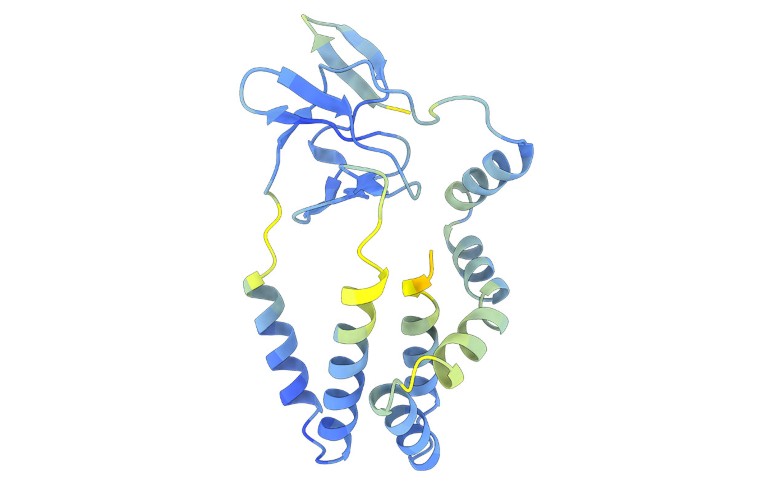
Le strutture previste hanno permesso agli autori di identificare le proteine di ingresso virale le cui sequenze differiscono notevolmente da quelle dei flavivirus conosciuti. Hanno trovato alcune connessioni inaspettate. Quindi il gruppo di virus che include l’epatite C utilizza un sistema per infettare le cellule simile a quello scoperto con i pestivirus, un gruppo che include il classico virus dell’influenza suina, che causa la febbre emorragica nei maiali, e altri agenti patogeni animali.
I confronti basati sull’intelligenza artificiale hanno mostrato che questo sistema di input è diverso da quello di molti altri flavivirus. "Per l'epatite C e i suoi parenti, non sappiamo da dove provenga il loro sistema di ingresso. Potrebbe essere stato inventato", dice Grove.
Rubato dai batteri
Le strutture previste hanno anche mostrato che le proteine input ben studiate dei virus Zika e dengue hanno le stesse origini di quelle dei flavivirus “strani e meravigliosi” con genomi enormi, incluso il virus della zecca Haseki, che può causare febbre negli esseri umani. Un'altra grande sorpresa è stata la scoperta che alcuni flavivirus possiedono un enzima che sembra essere stato rubato ai batteri.
"Questo sarebbe senza precedenti", dice la virologa Mary Petrone dell'Università di Sydney, in Australia, se non fosse per la scoperta da parte del suo team quest'anno di un furto simile di una specie di flavivirus particolarmente "strana e meravigliosa". 2. "La pirateria genetica potrebbe aver avuto un ruolo più importante di quanto si pensasse nell'evoluzione dei flavivirus", aggiunge.
David Moi, biologo computazionale dell’Università di Losanna, in Svizzera, afferma che lo studio sui flavivirus è solo la punta dell’iceberg e che è probabile che le storie evolutive di altri virus e persino di alcuni organismi cellulari vengano raccontate utilizzando l’intelligenza artificiale. "Ora che possiamo dare uno sguardo più approfondito, tutte queste cose necessitano di un piccolo aggiornamento", afferma.

 Suche
Suche
 Mein Konto
Mein Konto