Molekulārās rediģēšanas rīks, kas ir pietiekami mazs, lai to nogādātu smadzenēs, aptur proteīnu ražošanu, kas izraisa prionu slimības, retu, bet nāvējošu neirodeģeneratīvu traucējumu grupu.
Sistēma, kas pazīstama kā "saistītā histona aste automātiskai metiltransferāzes (CHARM) atbrīvošanai" maina "epigenomu" - ķīmisko marķējumu kolekciju, kas saistīta ar DNS un ietekmē gēnu aktivitāti. Pelēm CHARM apklusināja gēnu, kas ražo kaitīgās olbaltumvielas, kas izraisa prionu slimības lielākajā daļā smadzeņu neironu, nemainot gēnu secību.
CHARM ir pirmais solis ceļā uz drošas un efektīvas "vienreizējas ārstēšanas" izstrādi, lai samazinātu slimību izraisošo proteīnu līmeni, saka Madelynn Whittaker, Filadelfijas Pensilvānijas universitātes bioinženiere. Rezultāti tika paziņoti šodienZinātne 1publicēts.
"Sistēma risina ievērojamas problēmas, ar kurām saskaras iepriekšējās epiģenētiskās rediģēšanas sistēmas," saka Vitekers, pievienojot perspektīvais raksts iekšāZinātnelīdzautors. Tie ietver rediģēšanas rīku toksicitātes samazināšanu un to nogādāšanu šūnās, neapdraudot to efektivitāti, viņa piebilst.
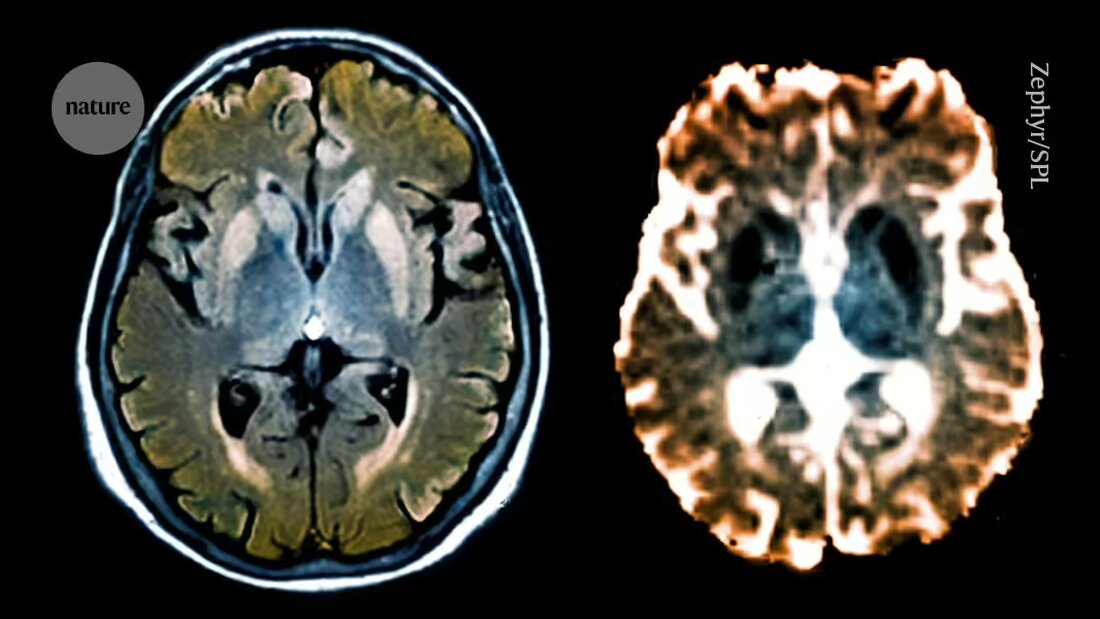
Prionu slimības izraisa nepareizi salocīti prionu proteīni (PrP), kas saplūst kopā un iznīcina neironus. Tas var izraisīt tādus apstākļus kā nāvējošs ģimenes bezmiega sindroms - reta ģenētiska slimība, kas neļauj cilvēkiem gulēt un izraisa nāvi. Lai gan prionu slimības ir neārstējamas, zāles, ko sauc par antisensu oligonukleotīdiem (ASO), ir parādījušas dažus daudzsološus rezultātus. Šīs īsās, vienpavedienu molekulas saistās ar kļūdainām ziņotāja RNS sekvencēm un palielina vai samazina olbaltumvielu ekspresiju. Iepriekšējie pētījumi ar pelēm, kas inficētas ar nepareizi salocītām PrP versijām, ir parādījuši, ka ASO samazina šo proteīnu ekspresiju un pagarina dzīves ilgumu. 2. Bet narkotikām ir nepieciešamas vairākas injekcijas, lai sasniegtu ilgstošu terapeitisko efektu, un tās var izraisīt blakusparādības, piemēram, aknu bojājumus, saka Whittaker.
2021. gadā Džonatans Veismens, Masačūsetsas Tehnoloģiju institūta Kembridžas bioķīmiķis, un viņa komanda izstrādāja CRISPRoff 3– rediģēšanas rīks, kas DNS virknei pievieno ķīmisko tagu, ko sauc par metilgrupu, kas samazina gēnu aktivitāti, nemainot genomu. Taču rīku nevar nogādāt smadzeņu šūnās, jo tā ģenētiskie komponenti ir pārāk lieli, lai ietilptu ar adeno saistītā vīrusa (AAV) - parastā transportlīdzekļa gēnu terapijas ievadīšanai šūnās. "Patiesais izaicinājums bija piegāde," saka Veismans.
Jauns redaktors
Lai to atrisinātu, Weissman un viņa komanda izstrādāja CHARM, kas izmanto molekulas, ko sauc par cinka pirkstu proteīniem, lai novirzītu sevi uz mērķa gēniem. Šīs olbaltumvielas ir pietiekami mazas, lai tās tiktu piegādātas AAV vektorā.
Pētnieki modificēja CHARM, lai piesaistītu un aktivizētu DNS metiltransferāžu komponentus - molekulas, kas atrodamas šūnās, kas pievieno metilgrupas DNS, izraisot gēnu ekspresijas izmaiņas. Tas samazina toksisko ietekmi, kas saistīta ar molekulu pievienošanu no ārpuses, saka Weissman. "Vienīgais, ko šūnā mainījām, bija tās spēja izteikt prionu proteīnu," viņš saka.
Kad pētnieki ievadīja CHARM veselu peļu smadzenēs, viņi atklāja, ka tas samazināja PrP ekspresiju visā smadzenēs par vairāk nekā 80% - krietni virs minimālā līmeņa, kas nepieciešams terapeitiskam efektam. Veismans un viņa komanda arī izstrādāja CHARM, lai to izslēgtu pēc tam, kad tas ir pabeidzis savu kluso darbu, neļaujot tai izveidot sevis kopijas, kas varētu izraisīt kaitīgas blakusparādības.
CHARM komandā ir Sonia Vallabh un viņas vīrs Ēriks Vallabs Minikels, prionu zinātnieki no MIT Plašā institūta un Hārvardas universitātes Kembridžā. Vallabhs pārņēma mutāciju, kas bija aiz nāvējošā ģimenes bezmiega sindroma, un pirms divpadsmit gadiem Vallabhs un Minikels mainīja karjeru, lai izpētītu slimības ārstēšanu. Vallabh saka, ka CHARM viņai sniedz "milzīgu pārliecību". Viņa piebilst, ka zāļu izstrāde parasti ir lēna, taču darbs parāda, cik ātri var izstrādāt jaunas pieejas ar pareizo komandu. "Tas, ko jūs varat sasniegt īsā laika periodā, ir neticami liels," saka Vallabh. "Tikai pirms diviem gadiem un mēneša mēs pirmo reizi iepazīstinājām Džonatanu ar ideju par sadarbību, un tagad mēs esam šeit."
CHARM ir arī potenciāls ārstēt citas slimības, ko izraisa patoloģisku proteīnu uzkrāšanās, piemēram, Parkinsona un Alcheimera slimību, piebilst Veismans. "Mēs zinām, ka epiģenētiskā klusēšana nedarbojas katram gēnam, bet lielākajai daļai gēnu," viņš saka.
Džeikobs Goells, pētnieks, kurš izstrādā epigenoma rediģēšanas rīkus Raisa universitātē Hjūstonā, Teksasā, ir optimistisks, ka CHARM kādu dienu nonāks klīnikā. Bet ir nepieciešams visaptverošāks darbs, lai novērtētu, kā rīks un tā radītās izmaiņas mijiedarbojas ar šūnu ģenētisko iekārtu, jo īpaši ilgākā laika periodā, viņš piebilst.
Nākamais solis ir izpētīt, kā CHARM darbojas AAV vektorā, kas var mērķēt uz cilvēka smadzeņu neironiem. "Šis ir nākamais lielais izaicinājums," viņš saka.

 Suche
Suche
 Mein Konto
Mein Konto