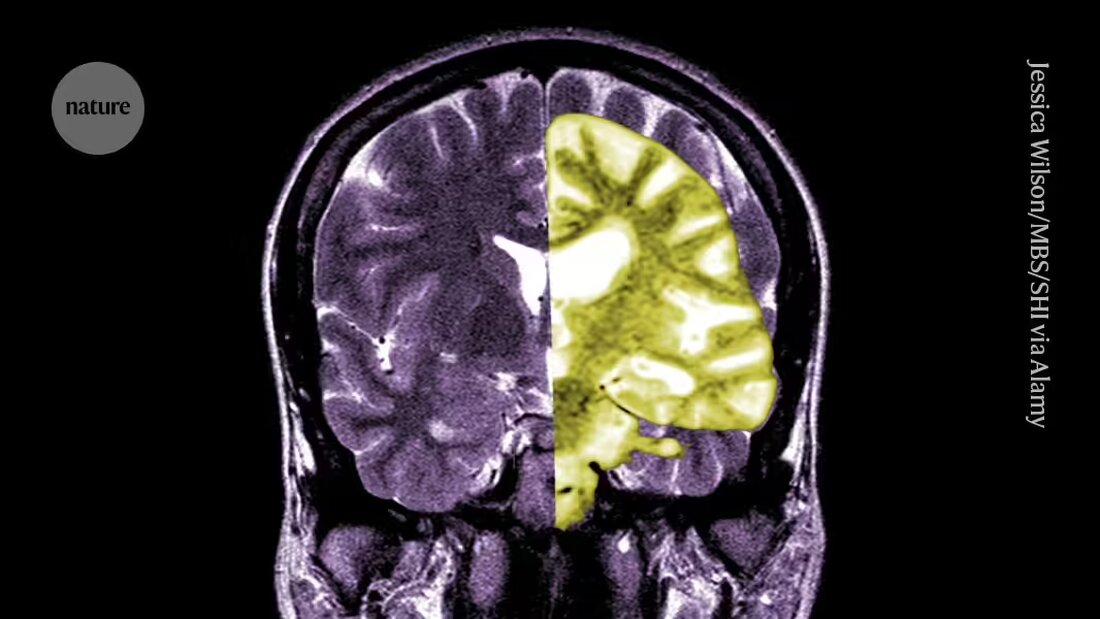
研究人员和临床医生关于阿尔茨海默病药物 Lecanemab 的争论正在加剧,该药物是首批减缓人类认知能力下降的药物之一,该药物的潜在益处是否大于其风险。
8月22日,英国药品和保健品监管局为该药物开了绿灯。然而与此同时,负责决定是否向英国国家资助的国民医疗服务体系(NHS)患者提供药物的英国卫生监管机构 NICE 在一份草案中表示,乐卡奈单抗不会在 NHS 上提供,因为收益太小,无法证明高昂的成本是合理的。
伦敦大学学院的精神病学家罗伯特·霍华德在给英国科学媒体中心的一份声明中说:“他们花在审查该药物上的时间异常长,这表明这不是一个容易或简单的决定。”
美国监管机构于 2023 年率先批准了该药物,欧洲药品管理局 (EMA) 在该制药商提出上诉后目前正在审查其决定。
淀粉样蛋白靶标
EMA 的决定也引起了阿尔茨海默病社区的不同反应。德国慕尼黑路德维希马克西米利安大学的生物化学家克里斯蒂安·哈斯表示:“这里的情绪确实很高涨。”他不同意这一决定。 “这是我们 30 多年来第一种缓解疾病的药物。”哈斯表示,拒绝患者获得乐卡奈单抗意味着许多人失去了获得宝贵时间的机会。
Lecanemab 或 Leqembi 是一种单克隆抗体,可以消除淀粉样蛋白,淀粉样蛋白是一种在阿尔茨海默病患者大脑中积聚成有毒团块的物质。该药物由东京的卫材公司和马萨诸塞州剑桥的百健公司生产,也在中国、日本、韩国和阿拉伯联合酋长国获得批准。
其他人则对 EMA 表示赞赏,称虽然该药物可以有效降低大脑中的淀粉样蛋白水平,但由此带来的认知能力下降的减少是否会给患者带来临床相关的益处仍不清楚。他们指出,由淀粉样蛋白相关成像效应(ARIA)的副作用引起的严重并发症(例如大脑出血或肿胀)的可能性虽然很小,但却是一个主要问题。 “对这种药物的风险与益处的合理评估应该会让人们非常怀疑,”田纳西州纳什维尔范德比尔特大学的神经学家马修·施拉格说。
影响不大
通过输注给予lecanemab是否可以为人们带来具有临床意义的认知能力下降减少长期以来一直存在争议。
该药物的 III 期临床试验于 2022 年发表,纳入了 1,795 名处于阿尔茨海默病早期阶段的患者,结果发现,与服用安慰剂的患者相比,服用该药物的患者在 18 个月后认知能力下降减少了 27%。一些研究人员庆祝这一消息,认为这是该领域的胜利。然而,其他人则认为影响太小,无法对患者产生有意义的影响。
英国剑桥大学公共卫生研究员塞巴斯蒂安·沃尔什表示,造成这种观点差异的原因之一是人们如何看待数据。 27% 的降低代表了药物组与安慰剂组相比认知能力下降程度的相对差异。然而,认知功能的绝对差异要小得多:18 分制中只有 0.45 分。 “人们可以从效应大小中提取他们想要的任何东西,”沃尔什说。 “如果他们想出售该药物,他们可以关注相对变化 - 如果他们非常怀疑,他们可以谈论绝对差异。”
沃尔什说,但随着时间的推移,即使是很小的影响也可能变得很严重,特别是在疾病的后期,降解发生得更快。 “最终这取决于你认为长期影响是什么,我们对此没有答案。”
现在可以获得一些长期数据。上个月在费城举行的阿尔茨海默病协会国际会议 (AAIC) 上,卫材和百健 (Biogen) 展示了一项开放标签扩展研究的结果,该研究继续监测 III 期试验完成后接受 Lecanemab 的患者。经过三年的持续治疗,超过一半的患者出现改善,大多数 ARIA 病例发生在治疗的前六个月。他们还报告说,当人们停止服用药物时,即使淀粉样蛋白斑块在治疗停止前已被去除,认知能力下降的速度也会恢复到安慰剂水平。
一些人对这些结果持乐观态度 - Haass 表示,令人兴奋的是,该药物不仅消除了淀粉样蛋白,而且还减缓了 tau 蛋白的扩散,tau 蛋白是另一种在阿尔茨海默病患者大脑中形成团块的蛋白质。其他人则更加谨慎。伦敦帝国理工学院的神经学家帕雷什·马尔霍特拉 (Paresh Malhotra) 指出,AAIC 上提出的积极结果并未与安慰剂进行比较,因此需要更多数据来确定该药物的长期有效性。
成本也是一个问题。沃尔什说,鉴于该药物的作用不大,很难证明该药物的管理成本(在美国每年花费超过 20,000 美元)以及确定适合接受该药物的人群所需的程序(例如成像和基因测试)是合理的。
安全问题
Lecanemab 最令人担忧的是 ARIA,美国食品和药物管理局 (FDA) 在批准时对此发出了警告。尽管大多数病例没有症状,而且在最初的 18 个月临床试验中没有报告任何病例,但在研究的扩展阶段,还是出现了一些与 ARIA 相关的死亡。
一些专家表示,尽管患严重 ARIA 的风险较低,但同样重要的是要考虑到该药物是在阿尔茨海默病的早期阶段给予的。 “这是人们失去最多的时期,”施拉格说。 “在此期间,我们经常鼓励患者去旅行,思考他们的愿望清单,并完成他们一生中想要完成的事情。”
荷兰莱顿大学医学中心的神经学家埃利斯·范埃滕 (Ellis van Etten) 表示,关于 ARIA 以及医生在看到患者在治疗期间出现这些异常时应如何应对,仍有许多未解答的问题。例如:谁会患上严重或危及生命的 ARIA? ARIA 在什么时候从无害变为有害?何时应停止 Lecanemab 治疗?
许多关于益处和风险的相同问题也适用于另一种淀粉样蛋白清除抗体 donanemab(由礼来公司在印第安纳州印第安纳波利斯生产),该抗体于 7 月获得 FDA 批准。 Donanemab 似乎可以像 Lecanamab 一样减少认知能力下降,并且与 ARIA 相关的死亡有关。
“我们从生物标志物研究中得知,这些抗体可以清除淀粉样蛋白,因此我们知道它们解决了该疾病的基本机制,”马尔霍特拉说。但仅靠这些药物可能还不够,解决该疾病的其他方面也很重要。 “十年后我们很可能会讨论联合疗法,而淀粉样蛋白清除将成为该方法的一部分。”

 Suche
Suche
 Mein Konto
Mein Konto