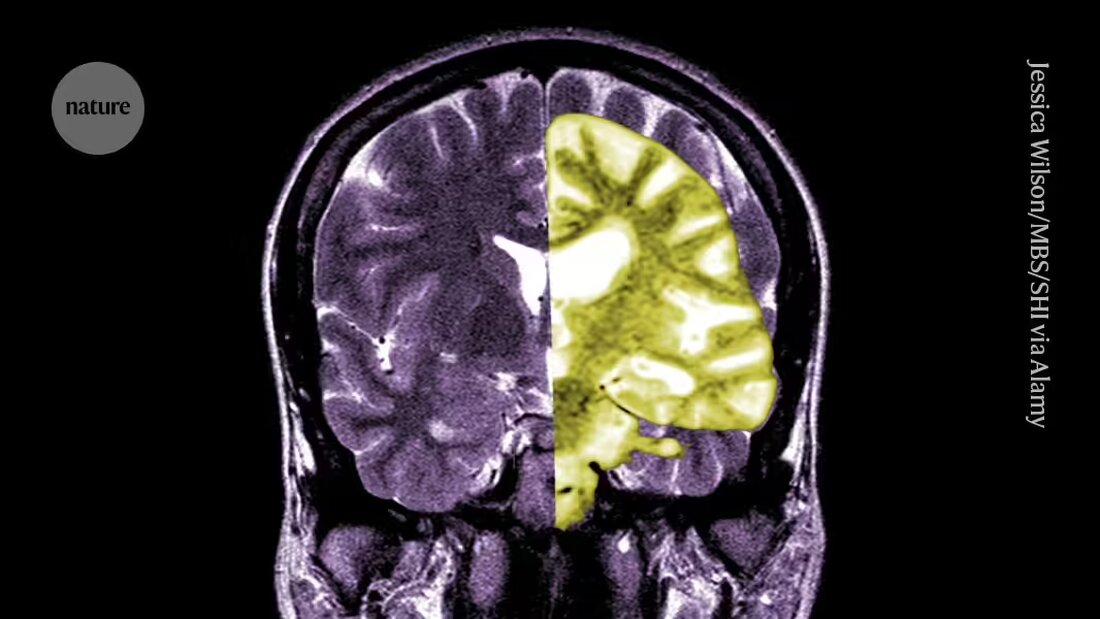
Debatten om Alzheimer-läkemedlet lecanemab – ett av de första läkemedlen som bromsar kognitiv nedgång hos människor – intensifieras bland forskare och läkare om huruvida behandlingens potentiella fördelar överväger riskerna.
Den 22 augusti gav Storbritanniens Medicines and Healthcare products Regulatory Agency läkemedlet grönt ljus. Samtidigt sa dock Storbritanniens hälsotillsynsmyndighet NICE, som avgör om läkemedel erbjuds patienter på Storbritanniens statligt finansierade National Health Service (NHS), i ett utkast att lecanemab inte skulle göras tillgängligt på NHS eftersom fördelarna var för små för att motivera den höga kostnaden.
"Den ovanligt långa tiden de ägnade åt att granska drogen tyder på att detta inte var ett lätt eller enkelt beslut", sa psykiatern Robert Howard vid University College London i ett uttalande till Science Media Center i Storbritannien.
Amerikanska tillsynsmyndigheter var de första som godkände läkemedlet 2023, och den europeiska läkemedelsmyndigheten (EMA) ser nu över sitt beslut efter en överklagan från läkemedelstillverkaren.
Amyloidmål
EMA:s beslut fick också blandade reaktioner från Alzheimer-gemenskapen. "Känslorna är verkligen höga här", säger biokemisten Christian Haass från Ludwig Maximilians University i München, Tyskland, som inte håller med om beslutet. "Det är det första sjukdomsmodifierande läkemedlet vi har haft på mer än 30 år." Att neka patienter tillgång till lecanemab innebär att många förlorar möjligheten att vinna värdefull tid, enligt Haass.
Lecanemab, eller Leqembi, är en monoklonal antikropp som eliminerar amyloid, ett ämne som byggs upp till giftiga klumpar i hjärnan hos personer med Alzheimers. Läkemedlet, tillverkat av Eisai i Tokyo och Biogen i Cambridge, Massachusetts, är även godkänt i Kina, Japan, Sydkorea och Förenade Arabemiraten.
Andra applåderar EMA och säger att även om läkemedlet har varit effektivt för att minska amyloidnivåerna i hjärnan, är det fortfarande oklart om den resulterande minskningen av kognitiv försämring kommer att resultera i kliniskt relevanta fördelar för patienterna. De anger att möjligheten för allvarliga komplikationer som blödning eller svullnad i hjärnan orsakade av en biverkning som kallas amyloidrelaterade bildeffekter (ARIA), även om den är liten, är ett stort problem. "En rimlig bedömning av riskerna kontra fördelarna med detta läkemedel bör leda till att människor är mycket skeptiska", säger Matthew Schrag, neurolog vid Vanderbilt University i Nashville, Tennessee.
Moderata effekter
Huruvida lecanemab administrerat genom infusion ger människor kliniskt meningsfulla minskningar av kognitiv försämring har länge diskuterats.
En klinisk fas III-prövning av läkemedlet, publicerad 2022, inkluderade 1 795 personer i de tidiga stadierna av Alzheimers sjukdom och fann att de som fick läkemedlet visade en 27 % minskning av kognitiv försämring efter 18 månader jämfört med de som fick placebo. Vissa forskare firade nyheten som en seger för fältet. Men andra hävdade att effekterna är för små för att ha en meningsfull inverkan på patienterna.
En av anledningarna till denna skillnad i perspektiv är hur människor ser på data, säger Sebastian Walsh, folkhälsoforskare vid University of Cambridge, Storbritannien. Minskningen på 27 % representerar den relativa skillnaden i mängden kognitiv försämring som läkemedelsgruppen upplever jämfört med placebogruppen. Den absoluta skillnaden i kognitiv funktion är dock mycket mindre: 0,45 poäng på en 18-gradig skala. "Människor kan extrahera vad de vill från effektstorleken", säger Walsh. "Om de vill sälja drogen kan de fokusera på relativa förändringar - och om de är mycket skeptiska kan de prata om de absoluta skillnaderna."
Men även små effekter kan bli betydande med tiden, särskilt i de senare stadierna av sjukdomen när nedbrytningen sker snabbare, säger Walsh. "I slutändan beror det på vad du tror vad den långsiktiga effekten kommer att bli, och vi har inget svar på det."
Vissa långtidsdata finns nu tillgängliga. Vid Alzheimer Association International Conference (AAIC) i Philadelphia förra månaden presenterade Eisai och Biogen resultat från en öppen förlängningsstudie som fortsatte att övervaka patienter som fick lecanemab efter avslutad fas III-studie. Efter tre års kontinuerlig behandling visade mer än hälften av patienterna förbättring, och de flesta fall av ARIA inträffade under de första sex månaderna av behandlingen. De rapporterade också att graden av kognitiv nedgång återgick till placebonivåer när människor slutade ta läkemedlet, även om amyloidplacken hade tagits bort innan behandlingen avbröts.
Vissa är optimistiska om dessa resultat – Haass säger att det är spännande att se att läkemedlet inte bara eliminerar amyloid, utan också bromsar spridningen av tau, ett annat protein som byggs upp till klumpar i hjärnan hos personer med Alzheimers. Andra är mer försiktiga. Paresh Malhotra, en neurolog vid Imperial College London, påpekar att de positiva resultaten som presenterades vid AAIC inte jämfördes med en placebo, så det behövs mer data för att fastställa läkemedlets långsiktiga effektivitet.
Kostnaden är också ett bekymmer. Walsh säger att med tanke på läkemedlets blygsamma effekter är det svårt att motivera kostnaden för att administrera läkemedlet (som kostar mer än 20 000 dollar per år i USA) och de procedurer som krävs, såsom bildbehandling och genetisk testning, för att identifiera berättigade personer att få det.
Säkerhetsproblem
Det största problemet med lecanemab är ARIA, som den amerikanska livsmedels- och läkemedelsmyndigheten (FDA) varnade för i sitt godkännande. Även om de flesta fall är asymtomatiska - och inga rapporterades under den första 18-månaders kliniska prövningen - fanns det några ARIA-relaterade dödsfall i den förlängda fasen av studien.
Vissa experter säger att även om risken för svår ARIA är låg är det också viktigt att tänka på att läkemedlet ges i de tidigaste stadierna av Alzheimers. "Det här är den period då människor har mest att förlora", säger Schrag. "Under det här fönstret uppmuntrar vi ofta patienter att resa, tänka på sin bucket list och åstadkomma de saker de vill åstadkomma i livet."
Ellis van Etten, neurolog vid Leiden University Medical Center i Nederländerna, säger att det fortfarande finns många obesvarade frågor om ARIA och hur läkare ska svara när de ser patienter utveckla dessa avvikelser under behandlingen. Till exempel: Vem kommer att utveckla allvarlig eller livshotande ARIA? När går ARIA från ofarligt till skadligt och när ska behandlingen med lecanemab avbrytas?
Många av samma frågor om fördelar och risker gäller även för en annan amyloid-clearing antikropp, donanemab - tillverkad av Eli Lilly i Indianapolis, Indiana - som godkändes av FDA i juli. Donanemab verkar ge ungefär samma minskning av kognitiv försämring som lecanamab - och det har kopplats till ARIA-relaterade dödsfall.
"Vi vet från biomarkörarbete att dessa antikroppar rensar amyloid, så vi vet att de adresserar en grundläggande mekanism för sjukdomen", säger Malhotra. Men dessa mediciner ensamma kommer förmodligen inte att räcka, och det kommer att vara viktigt att ta itu med andra aspekter av sjukdomen också. "Det är mycket troligt att vi om 10 år kommer att prata om kombinationsterapier och att amyloidclearance kommer att vara en del av det tillvägagångssättet."

 Suche
Suche
 Mein Konto
Mein Konto