Razprava o zdravilu za Alzheimerjevo bolezen lekanemab – enem od prvih zdravil za upočasnitev kognitivnega upada pri ljudeh – se med raziskovalci in zdravniki stopnjuje o tem, ali morebitne koristi zdravljenja odtehtajo njegova tveganja.
22. avgusta je britanska regulativna agencija za zdravila in zdravstvene izdelke dala zdravilo zeleno luč. Hkrati pa je britanski zdravstveni regulator NICE, ki določa, ali so zdravila ponujena bolnikom v britanski državni zdravstveni službi (NHS), dejal v osnutku, da lekanemab ne bo na voljo v NHS, ker so bile koristi premajhne, da bi upravičile visoke stroške.
"Nenavadno dolgo časa, ki so ga porabili za pregled zdravila, kaže, da to ni bila lahka ali preprosta odločitev," je v izjavi za Science Media Center v Veliki Britaniji dejal psihiater Robert Howard z University College London.
Ameriški regulatorji so leta 2023 prvi odobrili zdravilo, Evropska agencija za zdravila (EMA) pa zdaj pregleduje svojo odločitev po pritožbi proizvajalca zdravil.
Amiloidna tarča
Odločitev EMA je naletela tudi na mešane odzive skupnosti za Alzheimerjevo bolezen. "Čustva so tukaj resnično na višku," pravi biokemik Christian Haass z Univerze Ludwiga Maximiliansa v Münchnu v Nemčiji, ki se s to odločitvijo ne strinja. "To je prvo zdravilo za spreminjanje bolezni, ki smo ga imeli v več kot 30 letih." Če pacientom onemogočite dostop do lekanemaba, mnogi izgubijo priložnost pridobiti dragoceni čas, pravi Haass.
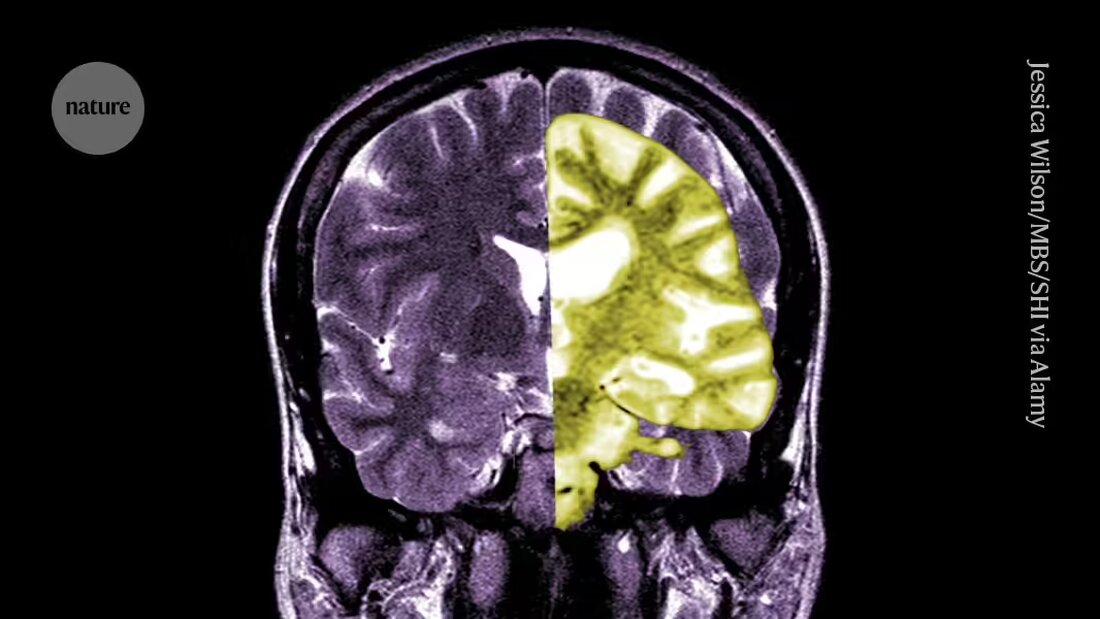
Lekanemab ali Leqembi je monoklonsko protitelo, ki odstrani amiloid, snov, ki se v možganih ljudi z Alzheimerjevo boleznijo kopiči v strupene grude. Zdravilo, ki ga proizvajata Eisai v Tokiu in Biogen v Cambridgeu v Massachusettsu, je odobreno tudi na Kitajskem, Japonskem, v Južni Koreji in Združenih arabskih emiratih.
Drugi ploskajo EMA, češ da je bilo zdravilo učinkovito pri zmanjševanju ravni amiloida v možganih, ostaja nejasno, ali bo posledično zmanjšanje kognitivnega upada povzročilo klinično pomembne koristi za bolnike. Navajajo, da je možnost resnih zapletov, kot so krvavitve ali otekline v možganih, ki jih povzroča stranski učinek, imenovan z amiloidom povezani slikovni učinki (ARIA), čeprav majhna, velika skrb. "Razumna ocena tveganja v primerjavi s koristmi tega zdravila bi morala pri ljudeh biti zelo skeptični," pravi Matthew Schrag, nevrolog na Univerzi Vanderbilt v Nashvillu, Tennessee.
Skromni učinki
Dolgo časa se razpravlja o tem, ali zdravilo Lekanemab, ki se daje z infuzijo, ljudem zagotavlja klinično pomembno zmanjšanje kognitivnega upada.
Klinično preizkušanje zdravila III. Nekateri raziskovalci so novico slavili kot zmago na tem področju. Vendar pa so drugi trdili, da so učinki premajhni, da bi imeli pomemben vpliv na bolnike.
Eden od razlogov za to razliko v perspektivi je, kako ljudje gledajo na podatke, pravi Sebastian Walsh, raziskovalec javnega zdravja na Univerzi v Cambridgeu v Veliki Britaniji. 27-odstotno zmanjšanje predstavlja relativno razliko v količini kognitivnega upada, ki ga je doživela skupina z zdravilom v primerjavi s skupino s placebom. Vendar pa je absolutna razlika v kognitivni funkciji precej manjša: 0,45 točke na 18-stopenjski lestvici. »Ljudje lahko iz velikosti učinka izvlečejo, kar hočejo,« pravi Walsh. "Če želijo prodati zdravilo, se lahko osredotočijo na relativne spremembe - in če so zelo skeptični, lahko govorijo o absolutnih razlikah."
Toda tudi majhni učinki lahko sčasoma postanejo pomembni, zlasti v poznejših fazah bolezni, ko pride do razgradnje hitreje, pravi Walsh. "Navsezadnje je odvisno od tega, kaj mislite, kakšen bo dolgoročni učinek, in na to nimamo odgovora."
Nekateri dolgoročni podatki so zdaj na voljo. Na mednarodni konferenci Alzheimerjevega združenja (AAIC) v Filadelfiji prejšnji mesec sta Eisai in Biogen predstavila rezultate odprte podaljšane študije, ki je nadaljevala s spremljanjem bolnikov, ki so prejemali lekanemab po zaključku preskušanja faze III. Po treh letih neprekinjenega zdravljenja je več kot polovica bolnikov pokazala izboljšanje, večina primerov ARIA pa se je pojavila v prvih šestih mesecih zdravljenja. Poročali so tudi, da se je stopnja kognitivnega upada vrnila na raven placeba, ko so ljudje prenehali jemati zdravilo, tudi če so bili amiloidni plaki odstranjeni pred prekinitvijo zdravljenja.
Nekateri so optimistični glede teh rezultatov – Haass pravi, da je vznemirljivo videti, da zdravilo ne le odpravlja amiloid, ampak tudi upočasnjuje širjenje tau, druge beljakovine, ki se kopiči v kepe v možganih ljudi z Alzheimerjevo boleznijo. Drugi so bolj previdni. Paresh Malhotra, nevrolog na Imperial College London, poudarja, da pozitivnih rezultatov, predstavljenih na AAIC, niso primerjali s placebom, zato je potrebnih več podatkov za določitev dolgoročne učinkovitosti zdravila.
Skrb vzbujajo tudi stroški. Walsh pravi, da je glede na skromne učinke zdravila težko upravičiti stroške dajanja zdravila (ki v ZDA stane več kot 20.000 dolarjev na leto) in potrebne postopke, kot sta slikanje in genetsko testiranje, za identifikacijo upravičenih ljudi do tega.
Pomisleki glede varnosti
Največja skrb pri lekanemabu je ARIA, na katero je v svoji odobritvi opozorila ameriška agencija za hrano in zdravila (FDA). Čeprav je večina primerov asimptomatskih - in med začetnim 18-mesečnim kliničnim preskušanjem niso poročali o nobenem - je bilo v razširjeni fazi študije nekaj smrti, povezanih z ARIA.
Nekateri strokovnjaki pravijo, da je kljub nizkemu tveganju za hudo ARIA pomembno upoštevati tudi, da se zdravilo daje v najzgodnejših fazah Alzheimerjeve bolezni. »To je obdobje, v katerem lahko ljudje največ izgubijo,« pravi Schrag. "Med tem oknom pogosto spodbujamo paciente, da potujejo, razmislijo o svojem seznamu in dosežejo stvari, ki jih želijo doseči v življenju."
Ellis van Etten, nevrolog iz medicinskega centra Leiden University na Nizozemskem, pravi, da je še vedno veliko neodgovorjenih vprašanj o ARIA in o tem, kako naj se zdravniki odzovejo, ko opazijo, da se pri bolnikih med zdravljenjem pojavijo te nepravilnosti. Na primer: Kdo bo razvil resno ali smrtno nevarno ARIA? Kdaj ARIA preide iz neškodljivega v škodljivega in kdaj je treba zdravljenje z lekanemabom prekiniti?
Mnoga od istih vprašanj o koristih in tveganjih veljajo tudi za drugo protitelo za čiščenje amiloida, donanemab, ki ga je izdelal Eli Lilly v Indianapolisu, Indiana, in ga je julija odobrila FDA. Zdi se, da donanemab zagotavlja približno enako zmanjšanje kognitivnega upada kot lekanamab – in je bil povezan s smrtnimi primeri, povezanimi z ARIA.
"Iz dela z biomarkerji vemo, da ta protitelesa očistijo amiloid, zato vemo, da obravnavajo temeljni mehanizem bolezni," pravi Malhotra. Toda samo ta zdravila verjetno ne bodo dovolj, zato bo pomembno obravnavati tudi druge vidike bolezni. "Zelo verjetno je, da bomo čez 10 let govorili o kombiniranih terapijah in da bo očistek amiloida del tega pristopa."

 Suche
Suche
 Mein Konto
Mein Konto