Medzi výskumníkmi a klinickými lekármi sa zintenzívňuje diskusia o liekoch na Alzheimerovu chorobu lecanemab – jednom z prvých liekov na spomalenie kognitívneho poklesu u ľudí, či potenciálne prínosy liečby prevažujú nad jej rizikami.
Britská agentúra pre reguláciu liekov a zdravotníckych produktov dala 22. augusta tomuto lieku zelenú. Zároveň však britský zdravotnícky regulátor NICE, ktorý určuje, či sa lieky ponúkajú pacientom v britskej štátom financovanej Národnej zdravotnej službe (NHS), v návrhu uviedol, že lecanemab nebude dostupný v NHS, pretože prínosy sú príliš malé na to, aby ospravedlnili vysoké náklady.
"Neobvykle dlhý čas, ktorý strávili skúmaním lieku, naznačuje, že to nebolo ľahké alebo jednoduché rozhodnutie," uviedol psychiater Robert Howard z University College London vo vyhlásení pre Science Media Center v Británii.
Americké regulačné orgány ako prvé schválili liek v roku 2023 a Európska lieková agentúra (EMA) teraz po odvolaní výrobcu liekov svoje rozhodnutie prehodnocuje.
Amyloidný cieľ
Rozhodnutie EMA vyvolalo zmiešané reakcie aj od Alzheimerovej komunity. „Emócie tu skutočne zúria,“ hovorí biochemik Christian Haass z Univerzity Ludwiga Maximiliansa v Mníchove v Nemecku, ktorý s rozhodnutím nesúhlasí. "Je to prvý liek modifikujúci chorobu, ktorý sme mali za viac ako 30 rokov." Odmietnutie prístupu pacientov k lecanemabu znamená, že mnohí podľa Haassa strácajú možnosť získať drahocenný čas.
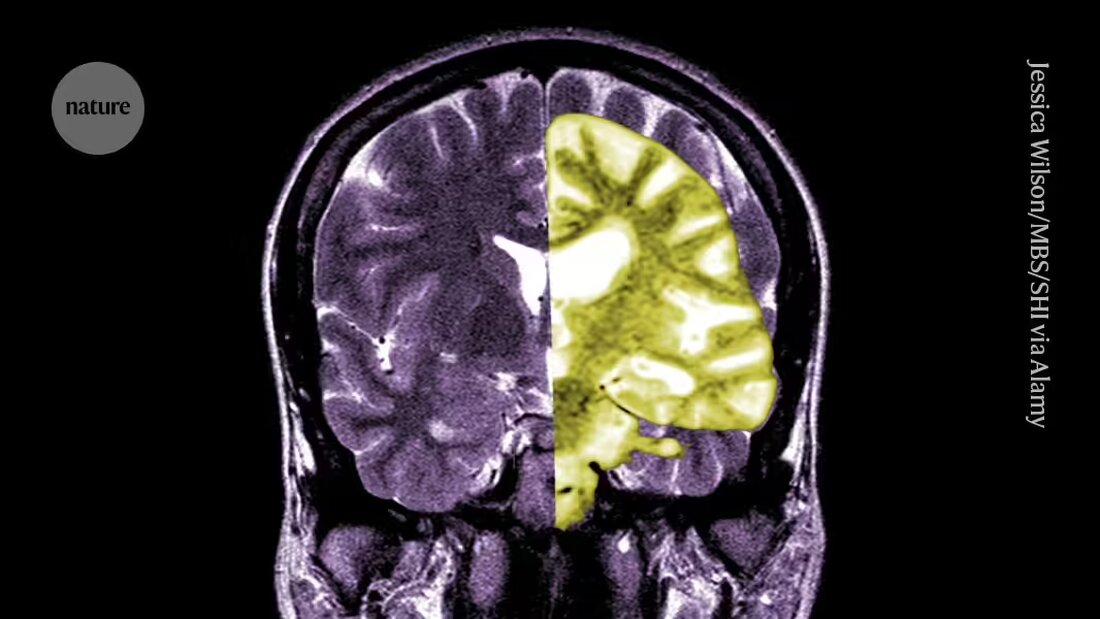
Lecanemab alebo Leqembi je monoklonálna protilátka, ktorá eliminuje amyloid, látku, ktorá sa ukladá do toxických zhlukov v mozgu ľudí s Alzheimerovou chorobou. Liek vyrobený spoločnosťami Eisai v Tokiu a Biogen v Cambridge v štáte Massachusetts je schválený aj v Číne, Japonsku, Južnej Kórei a Spojených arabských emirátoch.
Iní tlieskajú EMA a tvrdia, že zatiaľ čo liek bol účinný pri znižovaní hladín amyloidu v mozgu, zostáva nejasné, či výsledné zníženie kognitívneho poklesu bude mať za následok klinicky významné výhody pre pacientov. Uvádzajú, že možnosť vážnych komplikácií, ako je krvácanie alebo opuch mozgu spôsobený vedľajším účinkom nazývaným amyloid-related imaging effects (ARIA), hoci je malá, je veľkým problémom. "Rozumné posúdenie rizík a prínosov tohto lieku by malo viesť ľudí k tomu, aby boli veľmi skeptickí," hovorí Matthew Schrag, neurológ z Vanderbilt University v Nashville, Tennessee.
Skromné účinky
Už dlho sa diskutuje o tom, či lecanemab podávaný infúziou poskytuje ľuďom klinicky významné zníženie kognitívneho poklesu.
Fáza III klinickej štúdie lieku, publikovaná v roku 2022, zahŕňala 1 795 ľudí v počiatočných štádiách Alzheimerovej choroby a zistila, že tí, ktorí užívali liek, vykazovali 27% zníženie kognitívneho poklesu po 18 mesiacoch v porovnaní s tými, ktorí dostávali placebo. Niektorí výskumníci oslavovali túto správu ako víťazstvo pre túto oblasť. Iní však tvrdili, že účinky sú príliš malé na to, aby mali významný vplyv na pacientov.
Jedným z dôvodov tohto rozdielu v perspektíve je to, ako sa ľudia pozerajú na údaje, hovorí Sebastian Walsh, výskumník v oblasti verejného zdravia na University of Cambridge vo Veľkej Británii. 27 % zníženie predstavuje relatívny rozdiel v rozsahu kognitívneho poklesu, ktorý zaznamenala skupina s liekom v porovnaní so skupinou s placebom. Absolútny rozdiel v kognitívnych funkciách je však oveľa menší: 0,45 bodu na 18-bodovej škále. „Ľudia môžu z veľkosti efektu vytiahnuť čokoľvek, čo chcú,“ hovorí Walsh. "Ak chcú predávať liek, mohli by sa zamerať na relatívne zmeny - a ak sú veľmi skeptickí, mohli by hovoriť o absolútnych rozdieloch."
Ale aj malé účinky sa môžu časom stať významnými, najmä v neskorších štádiách ochorenia, keď k degradácii dochádza rýchlejšie, hovorí Walsh. "V konečnom dôsledku to závisí od toho, čo si myslíte, aký bude dlhodobý vplyv, a na to nemáme odpoveď."
Teraz sú k dispozícii niektoré dlhodobé údaje. Na medzinárodnej konferencii Alzheimerovej asociácie (AAIC) vo Philadelphii minulý mesiac Eisai a Biogen prezentovali výsledky otvorenej rozšírenej štúdie, ktorá pokračovala v monitorovaní pacientov, ktorí dostávali lecanemab po dokončení štúdie fázy III. Po troch rokoch nepretržitej liečby viac ako polovica pacientov vykazovala zlepšenie a väčšina prípadov ARIA sa vyskytla v prvých šiestich mesiacoch liečby. Uviedli tiež, že miera poklesu kognitívnych funkcií sa vrátila na úroveň placeba, keď ľudia prestali užívať liek, aj keď amyloidné plaky boli odstránené pred ukončením liečby.
Niektorí sú optimistickí, pokiaľ ide o tieto výsledky – Haass hovorí, že je vzrušujúce vidieť, že liek nielenže eliminuje amyloid, ale spomaľuje aj šírenie tau, ďalšieho proteínu, ktorý sa ukladá do zhlukov v mozgu ľudí s Alzheimerovou chorobou. Iní sú opatrnejší. Paresh Malhotra, neurológ z Imperial College London, poukazuje na to, že pozitívne výsledky prezentované na AAIC neboli porovnávané s placebom, takže na určenie dlhodobej účinnosti lieku je potrebných viac údajov.
Obavy vyvolávajú aj náklady. Walsh hovorí, že vzhľadom na skromné účinky lieku je ťažké odôvodniť náklady na podávanie lieku (ktoré v USA stojí viac ako 20 000 dolárov ročne) a potrebné postupy, ako je zobrazovanie a genetické testovanie, na identifikáciu oprávnených osôb, ktoré ho dostanú.
Obavy o bezpečnosť
Najväčšie znepokojenie v súvislosti s lecanemabom vyvoláva ARIA, na ktorú vo svojom schválení upozornil americký Úrad pre kontrolu potravín a liečiv (FDA). Hoci väčšina prípadov je asymptomatická - a žiadny nebol hlásený počas počiatočnej 18-mesačnej klinickej štúdie - v rozšírenej fáze štúdie sa vyskytli niektoré úmrtia súvisiace s ARIA.
Niektorí odborníci tvrdia, že aj keď je riziko ťažkej ARI nízke, je tiež dôležité vziať do úvahy, že liek sa podáva v najskorších štádiách Alzheimerovej choroby. „Toto je obdobie, v ktorom ľudia môžu najviac stratiť,“ hovorí Schrag. "Počas tohto okna často povzbudzujeme pacientov, aby cestovali, premýšľali o svojom zozname a dosiahli veci, ktoré chcú v živote dosiahnuť."
Ellis van Etten, neurológ z Leiden University Medical Center v Holandsku, hovorí, že stále existuje veľa nezodpovedaných otázok o ARIA a o tom, ako by lekári mali reagovať, keď vidia, že sa u pacientov počas liečby rozvinú tieto abnormality. Napríklad: U koho sa vyvinie vážna alebo život ohrozujúca ARIA? V akom bode sa ARIA mení z neškodnej na škodlivú a kedy by sa mala liečba lecanemabom ukončiť?
Mnohé z rovnakých otázok o výhodách a rizikách sa vzťahujú aj na inú protilátku odstraňujúcu amyloid, donanemab - vyrobenú spoločnosťou Eli Lilly v Indianapolise, Indiana - ktorú v júli schválila FDA. Zdá sa, že donanemab poskytuje približne rovnaké zníženie kognitívneho poklesu ako lecanamab – a je spojený s úmrtiami súvisiacimi s ARIA.
"Z práce biomarkerov vieme, že tieto protilátky odstraňujú amyloid, takže vieme, že riešia základný mechanizmus ochorenia," hovorí Malhotra. Ale len tieto lieky pravdepodobne stačiť nebudú a dôležité bude riešiť aj iné aspekty choroby. "Je veľmi pravdepodobné, že o 10 rokov budeme hovoriť o kombinovaných terapiách a že klírens amyloidu bude súčasťou tohto prístupu."

 Suche
Suche
 Mein Konto
Mein Konto