Dezbaterea cu privire la medicamentul Alzheimer lecanemab - unul dintre primele medicamente care încetinește declinul cognitiv la oameni - se intensifică în rândul cercetătorilor și clinicienilor cu privire la dacă beneficiile potențiale ale tratamentului depășesc riscurile sale.
Pe 22 august, Agenția de Reglementare a Medicamentului și Produselor de Sănătate din Marea Britanie a dat medicamentului undă verde. În același timp, însă, autoritatea britanică de reglementare în domeniul sănătății NICE, care stabilește dacă medicamentele sunt oferite pacienților în cadrul Serviciului Național de Sănătate (NHS) al Marii Britanii, finanțat de stat, a declarat într-un proiect că lecanemab nu va fi pus la dispoziție în NHS, deoarece beneficiile sunt prea mici pentru a justifica costul ridicat.
„Timpul neobișnuit de lung petrecut examinând medicamentul sugerează că aceasta nu a fost o decizie ușoară sau simplă”, a declarat psihiatru Robert Howard de la University College London într-o declarație pentru Science Media Center din Marea Britanie.
Autoritățile de reglementare din SUA au fost primele care au aprobat medicamentul în 2023, iar Agenția Europeană a Medicamentului (EMA) își revizuiește acum decizia în urma unui apel din partea producătorului de medicamente.
Țintă amiloid
Decizia EMA a primit, de asemenea, reacții mixte din partea comunității Alzheimer. „Emoțiile sunt foarte mari aici”, spune biochimistul Christian Haass de la Universitatea Ludwig Maximilians din München, Germania, care nu este de acord cu decizia. „Este primul medicament care modifică boala pe care l-am luat în mai bine de 30 de ani.” Interzicerea accesului pacienților la lecanemab înseamnă că mulți pierd oportunitatea de a câștiga timp prețios, potrivit Haass.
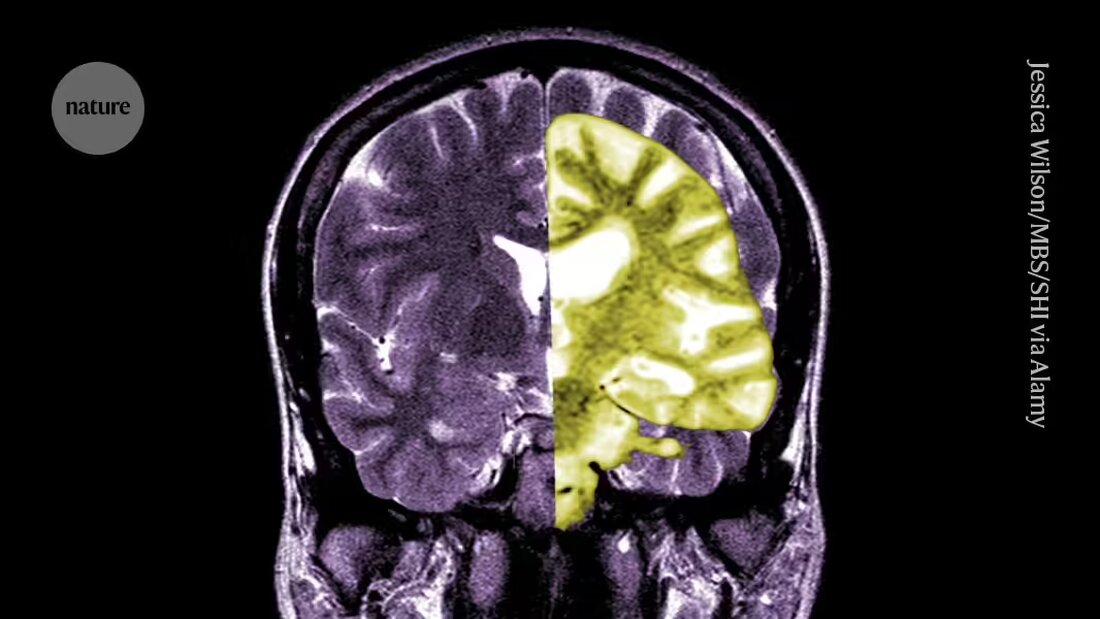
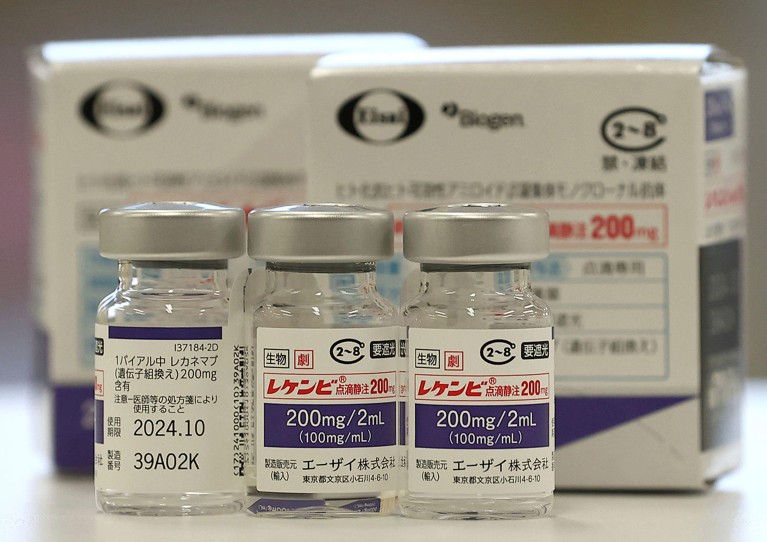
Lecanemab, sau Leqembi, este un anticorp monoclonal care elimină amiloidul, o substanță care se acumulează în aglomerări toxice în creierul persoanelor cu Alzheimer. Medicamentul, produs de Eisai în Tokyo și Biogen în Cambridge, Massachusetts, este aprobat și în China, Japonia, Coreea de Sud și Emiratele Arabe Unite.
Alții aplaudă EMA, spunând că, deși medicamentul a fost eficient în reducerea nivelurilor de amiloid din creier, rămâne neclar dacă reducerea rezultată a declinului cognitiv va avea ca rezultat beneficii relevante clinic pentru pacienți. Ei afirmă că posibilitatea apariției unor complicații grave, cum ar fi sângerarea sau umflarea creierului, cauzate de un efect secundar numit efecte de imagistică asociate amiloidului (ARIA), deși mici, este o preocupare majoră. „O evaluare rezonabilă a riscurilor față de beneficiile acestui medicament ar trebui să-i determine pe oameni să fie foarte sceptici”, spune Matthew Schrag, neurolog la Universitatea Vanderbilt din Nashville, Tennessee.
Efecte modeste
Dacă lecanemabul administrat prin perfuzie oferă oamenilor reduceri semnificative clinic ale declinului cognitiv a fost dezbătut de mult timp.
Un studiu clinic de fază III al medicamentului, publicat în 2022, a inclus 1.795 de persoane aflate în stadiile incipiente ale bolii Alzheimer și a constatat că cei care au primit medicamentul au prezentat o reducere cu 27% a declinului cognitiv după 18 luni, comparativ cu cei care au primit un placebo. Unii cercetători au celebrat vestea ca pe o victorie pentru domeniu. Cu toate acestea, alții au susținut că efectele sunt prea mici pentru a avea un impact semnificativ asupra pacienților.
Unul dintre motivele acestei diferențe de perspectivă este modul în care oamenii privesc datele, spune Sebastian Walsh, cercetător în domeniul sănătății publice la Universitatea din Cambridge, Marea Britanie. Reducerea de 27% reprezintă diferența relativă a cantității de declin cognitiv experimentat de grupul de droguri în comparație cu grupul placebo. Cu toate acestea, diferența absolută a funcției cognitive este mult mai mică: 0,45 puncte pe o scară de 18 puncte. „Oamenii pot extrage orice doresc din dimensiunea efectului”, spune Walsh. „Dacă vor să vândă medicamentul, s-ar putea concentra pe schimbări relative – iar dacă sunt foarte sceptici, ar putea vorbi despre diferențele absolute.”
Dar chiar și efectele mici pot deveni semnificative în timp, în special în etapele ulterioare ale bolii, când degradarea are loc mai rapid, spune Walsh. „În cele din urmă, depinde de ceea ce crezi, care va fi impactul pe termen lung și nu avem un răspuns la asta.”
Unele date pe termen lung sunt acum disponibile. La Conferința Internațională a Asociației Alzheimer (AAIC) din Philadelphia, luna trecută, Eisai și Biogen au prezentat rezultatele unui studiu de extensie deschis, care a continuat să monitorizeze pacienții cărora li s-a administrat lecanemab după finalizarea studiului de fază III. După trei ani de tratament continuu, mai mult de jumătate dintre pacienți au prezentat îmbunătățiri, iar majoritatea cazurilor de ARIA au apărut în primele șase luni de tratament. Ei au raportat, de asemenea, că rata declinului cognitiv a revenit la nivelurile placebo atunci când oamenii au încetat să ia medicamentul, chiar dacă plăcile de amiloid au fost îndepărtate înainte de oprirea tratamentului.
Unii sunt optimiști cu privire la aceste rezultate - Haass spune că este incitant să vezi că medicamentul nu numai că elimină amiloidul, ci și încetinește răspândirea tau, o altă proteină care se acumulează în aglomerări în creierul persoanelor cu Alzheimer. Alții sunt mai precauți. Paresh Malhotra, neurolog la Imperial College London, subliniază că rezultatele pozitive prezentate la AAIC nu au fost comparate cu un placebo, așa că sunt necesare mai multe date pentru a determina eficacitatea medicamentului pe termen lung.
Costul este, de asemenea, o preocupare. Walsh spune că, având în vedere efectele modeste ale medicamentului, este dificil de justificat costul administrării medicamentului (care costă mai mult de 20.000 de dolari pe an în SUA) și procedurile necesare, precum imagistica și testele genetice, pentru a identifica persoanele eligibile pentru a-l primi.
Probleme de siguranță
Cea mai mare îngrijorare cu lecanemab este ARIA, despre care Administrația SUA pentru Alimente și Medicamente (FDA) a avertizat în aprobarea sa. Deși majoritatea cazurilor sunt asimptomatice - și niciunul nu a fost raportat în timpul studiului clinic inițial de 18 luni - au existat unele decese legate de ARIA în faza extinsă a studiului.
Unii experți spun că, deși riscul de ARIA severă este scăzut, este de asemenea important să se ia în considerare faptul că medicamentul este administrat în stadiile incipiente ale bolii Alzheimer. „Aceasta este perioada în care oamenii au cel mai mult de pierdut”, spune Schrag. „În această fereastră, adesea încurajăm pacienții să călătorească, să se gândească la lista lor și să realizeze lucrurile pe care doresc să le realizeze în viață.”
Ellis van Etten, neurolog la Centrul Medical al Universității Leiden din Olanda, spune că există încă multe întrebări fără răspuns despre ARIA și despre cum ar trebui să răspundă medicii atunci când văd pacienții care dezvoltă aceste anomalii în timpul tratamentului. De exemplu: Cine va dezvolta ARIA gravă sau care pune viața în pericol? În ce moment trece ARIA de la inofensiv la dăunător și când trebuie întrerupt tratamentul cu lecanemab?
Multe dintre aceleași întrebări despre beneficii și riscuri se aplică și unui alt anticorp de curățare a amiloidului, donanemab - produs de Eli Lilly în Indianapolis, Indiana - care a fost aprobat de FDA în iulie. Donanemab pare să ofere aproximativ aceeași reducere a declinului cognitiv ca și lecanamabul - și a fost asociat cu decesele legate de ARIA.
„Știm din munca de biomarker că acești anticorpi clarifică amiloidul, așa că știm că abordează un mecanism fundamental al bolii”, spune Malhotra. Dar aceste medicamente singure probabil nu vor fi suficiente și va fi important să abordăm și alte aspecte ale bolii. „Este foarte probabil ca în 10 ani să vorbim despre terapii combinate și că clearance-ul amiloidului va face parte din această abordare.”

 Suche
Suche
 Mein Konto
Mein Konto