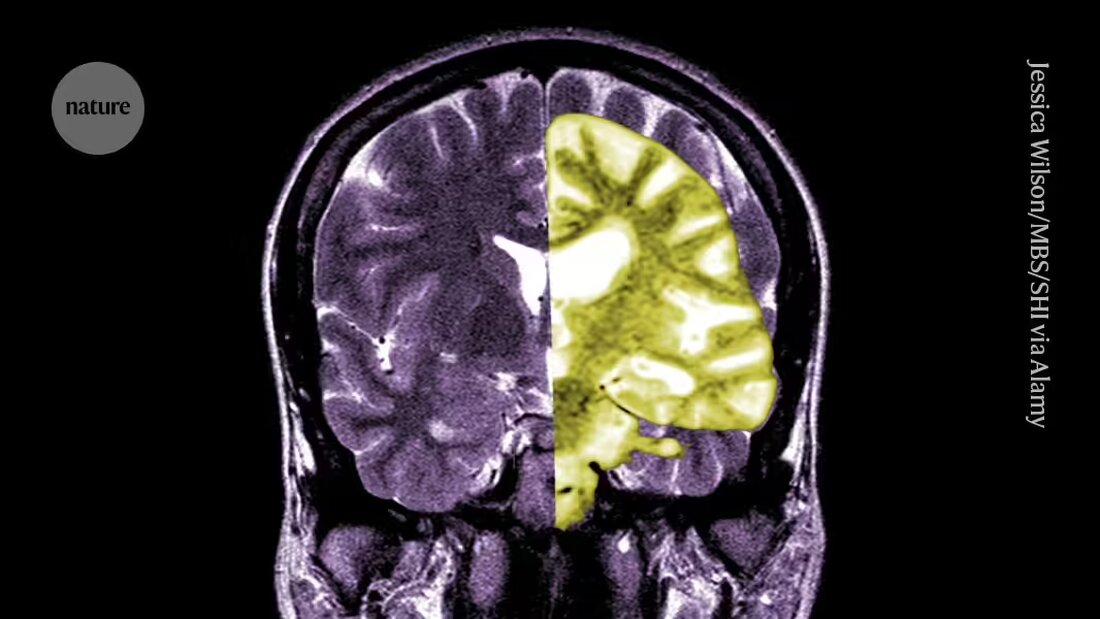
Debata na temat leku na chorobę Alzheimera, lekanemabu – jednego z pierwszych leków spowalniających pogorszenie funkcji poznawczych u ludzi – nasila się wśród badaczy i klinicystów na temat tego, czy potencjalne korzyści z leczenia przewyższają ryzyko.
22 sierpnia brytyjska Agencja Regulacyjna ds. Leków i Produktów Opieki Zdrowotnej dała lekowi zielone światło. Jednocześnie jednak brytyjski organ regulacyjny ds. zdrowia NICE, który określa, czy leki są oferowane pacjentom finansowanej przez państwo brytyjskiej krajowej służby zdrowia (NHS), stwierdził w projekcie, że lekanemab nie będzie udostępniany w ramach NHS, ponieważ korzyści będą zbyt małe, aby uzasadnić wysokie koszty.
„Niezwykle długi czas, jaki spędzili na recenzowaniu leku, sugeruje, że nie była to łatwa ani prosta decyzja” – stwierdził psychiatra Robert Howard z University College London w oświadczeniu dla Science Media Centre w Wielkiej Brytanii.
Amerykańskie organy regulacyjne jako pierwsze zatwierdziły lek w 2023 r., a Europejska Agencja Leków (EMA) weryfikuje obecnie swoją decyzję w następstwie odwołania złożonego przez producenta leku.
Cel amyloidowy
Decyzja EMA spotkała się również z mieszanymi reakcjami społeczności osób chorych na Alzheimera. „Emocje są tu naprawdę ogromne” – mówi biochemik Christian Haass z Uniwersytetu Ludwiga Maximiliana w Monachium w Niemczech, który nie zgadza się z tą decyzją. „To pierwszy lek modyfikujący przebieg choroby, jaki mamy od ponad 30 lat”. Według Haassa odmowa pacjentom dostępu do lekanemabu oznacza, że wiele osób traci możliwość zyskania cennego czasu.
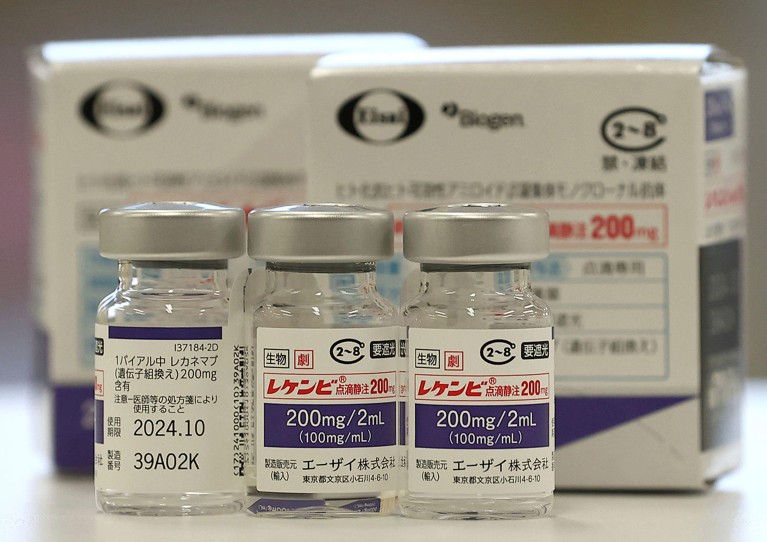
Lecanemab, czyli Leqembi, to przeciwciało monoklonalne, które eliminuje amyloid – substancję, która gromadzi się w toksycznych grudkach w mózgach osób chorych na chorobę Alzheimera. Lek wytwarzany przez Eisai w Tokio i Biogen w Cambridge w stanie Massachusetts jest również zatwierdzony w Chinach, Japonii, Korei Południowej i Zjednoczonych Emiratach Arabskich.
Inni pochwalają EMA, twierdząc, że chociaż lek jest skuteczny w zmniejszaniu poziomu amyloidu w mózgu, nie jest jasne, czy wynikające z tego zmniejszenie pogorszenia funkcji poznawczych przyniesie pacjentom klinicznie istotne korzyści. Twierdzą, że poważnym problemem jest możliwość wystąpienia poważnych powikłań, takich jak krwawienie lub obrzęk mózgu, spowodowanych działaniem niepożądanym zwanym efektami obrazowania związanymi z amyloidem (ARIA), choć niewielkimi. „Rozsądna ocena ryzyka i korzyści związanych ze stosowaniem tego leku powinna skłonić ludzi do dużego sceptycyzmu” – mówi Matthew Schrag, neurolog z Vanderbilt University w Nashville w stanie Tennessee.
Skromne efekty
Od dawna debatowano nad tym, czy lekanemab podawany we wlewie zapewnia ludziom klinicznie znaczące zmniejszenie pogorszenia funkcji poznawczych.
Badanie kliniczne III fazy leku, opublikowane w 2022 r., objęło 1795 osób we wczesnych stadiach choroby Alzheimera i wykazało, że u osób, które otrzymały lek, po 18 miesiącach zaobserwowano 27% redukcję pogorszenia funkcji poznawczych w porównaniu z osobami, które otrzymały placebo. Niektórzy badacze świętowali tę wiadomość jako zwycięstwo w tej dziedzinie. Inni jednak argumentowali, że skutki są zbyt małe, aby mieć znaczący wpływ na pacjentów.
Jedną z przyczyn tej różnicy perspektyw jest sposób, w jaki ludzie patrzą na dane, mówi Sebastian Walsh, badacz zdrowia publicznego na Uniwersytecie Cambridge w Wielkiej Brytanii. Redukcja o 27% reprezentuje względną różnicę w stopniu pogorszenia funkcji poznawczych doświadczanego przez grupę leczoną lekiem w porównaniu z grupą placebo. Jednak bezwzględna różnica w funkcjach poznawczych jest znacznie mniejsza: 0,45 punktu w 18-punktowej skali. „Ludzie mogą wydobyć z wielkości efektu wszystko, co chcą” – mówi Walsh. „Jeśli chcą sprzedać lek, mogą skupić się na względnych zmianach, a jeśli są bardzo sceptyczni, mogą mówić o absolutnych różnicach”.
Jednak nawet niewielkie efekty mogą z czasem stać się znaczące, szczególnie w późniejszych stadiach choroby, gdy degradacja następuje szybciej, mówi Walsh. „Ostatecznie zależy to od tego, co myślisz, jakie będą długoterminowe skutki, ale nie mamy na to odpowiedzi”.
Dostępne są już pewne dane długoterminowe. W zeszłym miesiącu na Międzynarodowej Konferencji Stowarzyszenia Alzheimera (AAIC) w Filadelfii Eisai i Biogen przedstawili wyniki otwartego badania kontynuacyjnego, w którym kontynuowano monitorowanie pacjentów otrzymujących lekanemab po zakończeniu badania III fazy. Po trzech latach ciągłego leczenia u ponad połowy pacjentów zaobserwowano poprawę, a większość przypadków ARIA wystąpiła w ciągu pierwszych sześciu miesięcy leczenia. Poinformowali także, że po zaprzestaniu przyjmowania leku wskaźnik pogorszenia funkcji poznawczych powrócił do poziomu placebo, nawet jeśli przed zaprzestaniem leczenia usunięto blaszki amyloidowe.
Niektórzy są optymistami co do tych wyników. Haass twierdzi, że ekscytujące jest obserwowanie, że lek nie tylko eliminuje amyloid, ale także spowalnia rozprzestrzenianie się tau, innego białka, które gromadzi się w grudki w mózgach osób chorych na Alzheimera. Inni są bardziej ostrożni. Paresh Malhotra, neurolog z Imperial College London, zwraca uwagę, że pozytywnych wyników zaprezentowanych w badaniu AAIC nie porównano z placebo, dlatego potrzeba więcej danych, aby określić długoterminową skuteczność leku.
Koszt jest również problemem. Walsh twierdzi, że biorąc pod uwagę skromne działanie leku, trudno uzasadnić koszt jego podawania (który w USA kosztuje ponad 20 000 dolarów rocznie) oraz wymagane procedury, takie jak obrazowanie i badania genetyczne, umożliwiające identyfikację osób kwalifikujących się do jego otrzymania.
Obawy dotyczące bezpieczeństwa
Największą obawą związaną z lekanemabem jest ARIA, przed którą ostrzegała amerykańska Agencja ds. Żywności i Leków (FDA) w swojej decyzji o zatwierdzeniu leku. Chociaż większość przypadków przebiega bezobjawowo i żadnego nie zgłoszono podczas początkowego 18-miesięcznego badania klinicznego, w przedłużonej fazie badania wystąpiły pewne zgony związane z ARIA.
Niektórzy eksperci twierdzą, że chociaż ryzyko ciężkiego ARIA jest niskie, należy również wziąć pod uwagę, że lek podaje się we wczesnych stadiach choroby Alzheimera. „To okres, w którym ludzie mają najwięcej do stracenia” – mówi Schrag. „W tym okresie często zachęcamy pacjentów do podróżowania, zastanawiania się nad swoją listą życzeń i realizowania rzeczy, które chcą osiągnąć w życiu”.
Ellis van Etten, neurolog z Leiden University Medical Center w Holandii, twierdzi, że nadal istnieje wiele pytań bez odpowiedzi na temat ARIA i tego, jak lekarze powinni reagować, gdy widzą, że u pacjentów rozwijają się takie nieprawidłowości w trakcie leczenia. Na przykład: U kogo rozwinie się poważna lub zagrażająca życiu ARIA? W którym momencie ARIA zmienia się z nieszkodliwego na szkodliwy i kiedy należy przerwać leczenie lekanemabem?
Wiele z tych samych pytań dotyczących korzyści i ryzyka dotyczy także innego przeciwciała usuwającego amyloid, donanemabu – produkowanego przez Eli Lilly w Indianapolis w stanie Indiana – który został zatwierdzony przez FDA w lipcu. Wydaje się, że donanemab zapewnia mniej więcej takie samo zmniejszenie pogorszenia funkcji poznawczych jak lekanamab – i powiązano go ze zgonami związanymi z ARIA.
„Z prac nad biomarkerami wiemy, że te przeciwciała usuwają amyloid, więc wiemy, że wpływają na podstawowy mechanizm choroby” – mówi Malhotra. Jednak same leki prawdopodobnie nie wystarczą i ważne będzie zajęcie się także innymi aspektami choroby. „Jest bardzo prawdopodobne, że za 10 lat będziemy mówić o terapiach skojarzonych i że usuwanie amyloidu będzie częścią tego podejścia”.

 Suche
Suche
 Mein Konto
Mein Konto