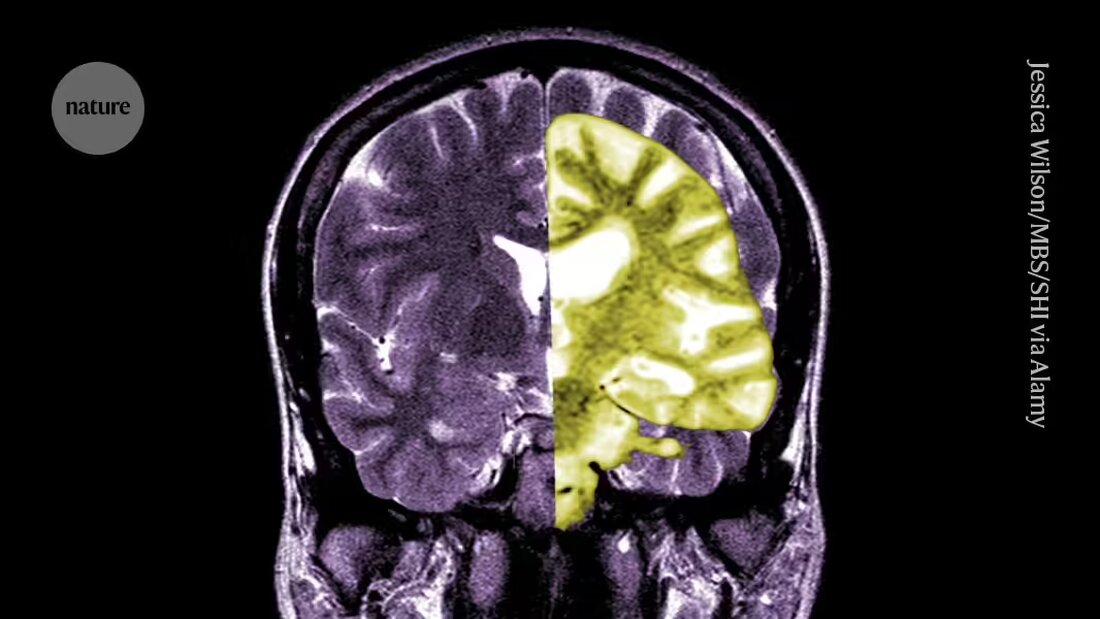
Debatten om Alzheimers-legemidlet lecanemab - et av de første legemidlene som bremser kognitiv nedgang hos mennesker - intensiveres blant forskere og klinikere om hvorvidt behandlingens potensielle fordeler oppveier risikoen.
22. august ga Storbritannias reguleringsbyrå for legemidler og helseprodukter grønt lys for stoffet. Samtidig sa imidlertid Storbritannias helseregulator NICE, som avgjør om legemidler tilbys pasienter på Storbritannias statsfinansierte National Health Service (NHS), i et utkast at lecanemab ikke ville bli gjort tilgjengelig på NHS fordi fordelene var for små til å rettferdiggjøre de høye kostnadene.
"Den uvanlig lange tiden de brukte på å vurdere stoffet tyder på at dette ikke var en enkel eller enkel avgjørelse," sa psykiater Robert Howard ved University College London i en uttalelse til Science Media Center i Storbritannia.
Amerikanske regulatorer var de første som godkjente stoffet i 2023, og European Medicines Agency (EMA) vurderer nå sin avgjørelse etter en anke fra legemiddelprodusenten.
Amyloid mål
EMAs avgjørelse fikk også blandede reaksjoner fra Alzheimer-miljøet. "Følelsene er virkelig høye her," sier biokjemiker Christian Haass ved Ludwig Maximilians University i München, Tyskland, som er uenig i avgjørelsen. "Det er det første sykdomsmodifiserende stoffet vi har hatt på mer enn 30 år." Å nekte pasienter tilgang til lecanemab betyr at mange mister muligheten til å vinne verdifull tid, ifølge Haass.
Lecanemab, eller Leqembi, er et monoklonalt antistoff som eliminerer amyloid, et stoff som bygges opp til giftige klumper i hjernen til personer med Alzheimers. Legemidlet, laget av Eisai i Tokyo og Biogen i Cambridge, Massachusetts, er også godkjent i Kina, Japan, Sør-Korea og De forente arabiske emirater.
Andre applauderer EMA, og sier at selv om stoffet har vært effektivt for å redusere amyloidnivåer i hjernen, er det fortsatt uklart om den resulterende reduksjonen i kognitiv nedgang vil resultere i klinisk relevante fordeler for pasientene. De sier at muligheten for alvorlige komplikasjoner som blødning eller hevelse i hjernen forårsaket av en bivirkning som kalles amyloid-relaterte bildeeffekter (ARIA), selv om de er små, er en stor bekymring. "En rimelig vurdering av risikoen kontra fordelene med dette stoffet bør føre til at folk er veldig skeptiske," sier Matthew Schrag, en nevrolog ved Vanderbilt University i Nashville, Tennessee.
Beskjedne effekter
Hvorvidt lecanemab administrert ved infusjon gir mennesker klinisk meningsfulle reduksjoner i kognitiv nedgang har lenge vært diskutert.
En klinisk fase III-studie av stoffet, publisert i 2022, inkluderte 1 795 personer i de tidlige stadiene av Alzheimers sykdom og fant at de som fikk stoffet viste en 27 % reduksjon i kognitiv nedgang etter 18 måneder sammenlignet med de som fikk placebo. Noen forskere feiret nyheten som en seier for feltet. Andre hevdet imidlertid at effektene er for små til å ha en meningsfull innvirkning på pasientene.
En av grunnene til denne forskjellen i perspektiv er hvordan folk ser på dataene, sier Sebastian Walsh, en folkehelseforsker ved University of Cambridge, Storbritannia. Reduksjonen på 27 % representerer den relative forskjellen i mengden kognitiv nedgang som legemiddelgruppen opplever sammenlignet med placebogruppen. Den absolutte forskjellen i kognitiv funksjon er imidlertid mye mindre: 0,45 poeng på en 18-punkts skala. "Folk kan trekke ut hva de vil fra effektstørrelsen," sier Walsh. "Hvis de ønsker å selge stoffet, kan de fokusere på relative endringer - og hvis de er veldig skeptiske, kan de snakke om de absolutte forskjellene."
Men selv små effekter kan bli betydelige over tid, spesielt i de senere stadier av sykdommen når nedbrytning skjer raskere, sier Walsh. "Til syvende og sist avhenger det av hva du tror hva den langsiktige effekten vil være, og vi har ikke noe svar på det."
Noen langtidsdata er nå tilgjengelige. På Alzheimer Association International Conference (AAIC) i Philadelphia i forrige måned presenterte Eisai og Biogen resultater fra en åpen utvidelsesstudie som fortsatte å overvåke pasienter som fikk lecanemab etter fullføring av fase III-studien. Etter tre år med kontinuerlig behandling viste mer enn halvparten av pasientene bedring, og de fleste tilfeller av ARIA oppsto i løpet av de første seks månedene av behandlingen. De rapporterte også at frekvensen av kognitiv nedgang gikk tilbake til placebonivå når folk sluttet å ta stoffet, selv om amyloidplakkene hadde blitt fjernet før behandlingen ble stoppet.
Noen er optimistiske med tanke på disse resultatene – Haass sier det er spennende å se at stoffet ikke bare eliminerer amyloid, men også bremser spredningen av tau, et annet protein som bygger seg opp til klumper i hjernen til personer med Alzheimers. Andre er mer forsiktige. Paresh Malhotra, en nevrolog ved Imperial College London, påpeker at de positive resultatene som ble presentert ved AAIC ikke ble sammenlignet med en placebo, så mer data er nødvendig for å bestemme stoffets langsiktige effektivitet.
Kostnader er også en bekymring. Walsh sier at gitt stoffets beskjedne effekter, er det vanskelig å rettferdiggjøre kostnadene ved å administrere stoffet (som koster mer enn $20 000 i året i USA) og prosedyrene som kreves, som bildediagnostikk og genetisk testing, for å identifisere kvalifiserte personer til å motta det.
Sikkerhetshensyn
Den største bekymringen med lecanemab er ARIA, som US Food and Drug Administration (FDA) advarte om i sin godkjenning. Selv om de fleste tilfeller er asymptomatiske - og ingen ble rapportert under den første 18-måneders kliniske studien - var det noen ARIA-relaterte dødsfall i den utvidede fasen av studien.
Noen eksperter sier at selv om risikoen for alvorlig ARIA er lav, er det også viktig å vurdere at stoffet gis i de tidligste stadiene av Alzheimers. "Dette er den perioden folk har mest å tape," sier Schrag. "I løpet av dette vinduet oppfordrer vi ofte pasienter til å reise, tenke på bøttelisten deres og oppnå de tingene de ønsker å oppnå i livet."
Ellis van Etten, en nevrolog ved Leiden University Medical Center i Nederland, sier at det fortsatt er mange ubesvarte spørsmål om ARIA og hvordan leger bør reagere når de ser pasienter utvikle disse abnormitetene under behandlingen. For eksempel: Hvem vil utvikle alvorlig eller livstruende ARIA? På hvilket tidspunkt går ARIA fra ufarlig til skadelig, og når bør behandling med lecanemab stoppes?
Mange av de samme spørsmålene om fordeler og risiko gjelder også for et annet amyloid-clearing antistoff, donanemab - laget av Eli Lilly i Indianapolis, Indiana - som ble godkjent av FDA i juli. Donanemab ser ut til å gi omtrent samme reduksjon i kognitiv nedgang som lecanamab - og det har vært knyttet til ARIA-relaterte dødsfall.
"Vi vet fra biomarkørarbeid at disse antistoffene fjerner amyloid, så vi vet at de adresserer en grunnleggende mekanisme for sykdommen," sier Malhotra. Men disse medisinene alene vil sannsynligvis ikke være nok, og det vil være viktig å ta tak i andre aspekter ved sykdommen også. "Det er svært sannsynlig at vi om 10 år vil snakke om kombinasjonsterapier og at amyloidclearance vil være en del av den tilnærmingen."

 Suche
Suche
 Mein Konto
Mein Konto