Het debat over het Alzheimermedicijn lecanemab – een van de eerste medicijnen die de cognitieve achteruitgang bij mensen vertraagt – wordt steeds heviger onder onderzoekers en artsen over de vraag of de potentiële voordelen van de behandeling opwegen tegen de risico’s ervan.
Op 22 augustus gaf de Britse Medicines and Healthcare products Regulatory Agency het medicijn groen licht. Tegelijkertijd zei de Britse gezondheidsregulator NICE, die bepaalt of medicijnen worden aangeboden aan patiënten van de door de Britse staat gefinancierde National Health Service (NHS), echter in een ontwerp dat lecanemab niet beschikbaar zou worden gesteld op de NHS omdat de voordelen te klein waren om de hoge kosten te rechtvaardigen.
“De ongewoon lange tijd die ze besteedden aan het beoordelen van het medicijn suggereert dat dit geen gemakkelijke of eenvoudige beslissing was”, zei psychiater Robert Howard van University College London in een verklaring aan het Science Media Centre in Groot-Brittannië.
Amerikaanse toezichthouders waren de eersten die het medicijn in 2023 goedkeurden, en het Europees Geneesmiddelenbureau (EMA) herziet nu zijn besluit na een beroep van de medicijnfabrikant.
Amyloïde doelwit
Het besluit van het EMA kreeg ook gemengde reacties uit de Alzheimergemeenschap. “De emoties lopen hier echt hoog op”, zegt biochemicus Christian Haass van de Ludwig Maximilians Universiteit in München, Duitsland, die het niet eens is met de beslissing. “Het is het eerste ziektemodificerende medicijn dat we in meer dan dertig jaar hebben gehad.” Door patiënten de toegang tot lecanemab te ontzeggen, verliezen velen de kans om waardevolle tijd te winnen, aldus Haass.
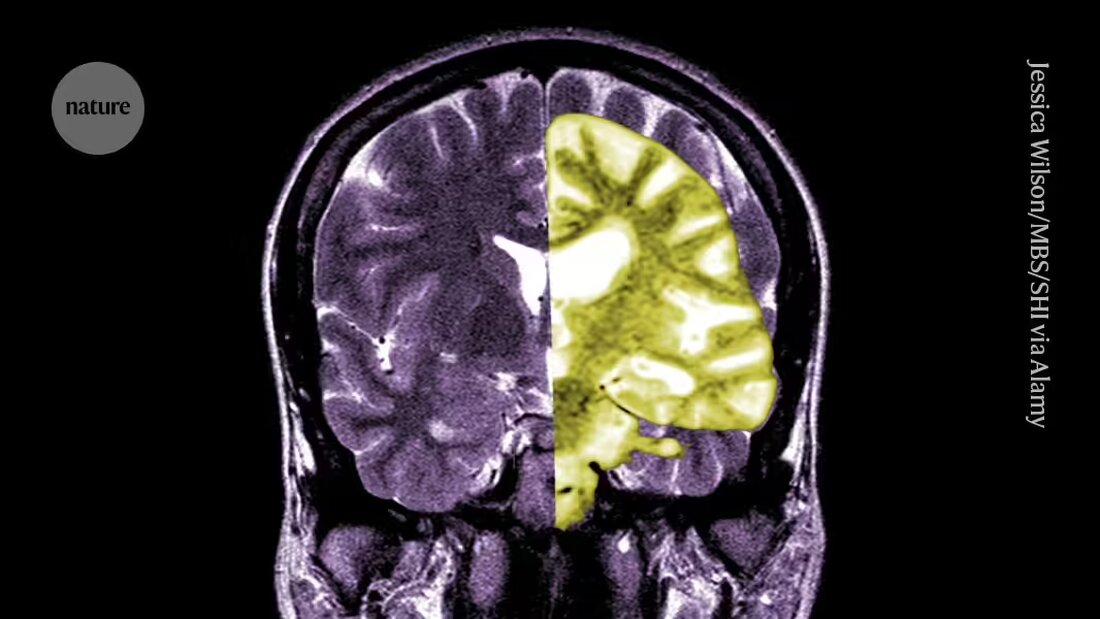
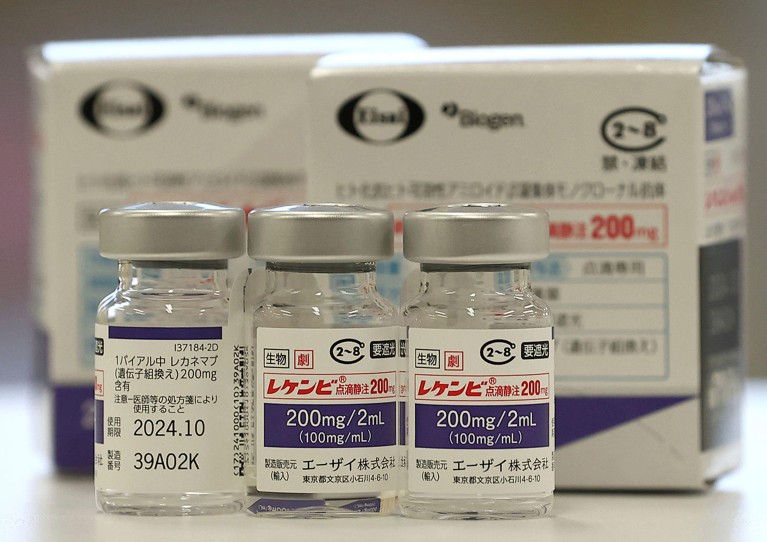
Lecanemab, of Leqembi, is een monoklonaal antilichaam dat amyloïde elimineert, een stof die zich ophoopt tot giftige klontjes in de hersenen van mensen met de ziekte van Alzheimer. Het medicijn, gemaakt door Eisai in Tokio en Biogen in Cambridge, Massachusetts, is ook goedgekeurd in China, Japan, Zuid-Korea en de Verenigde Arabische Emiraten.
Anderen juichen de EMA toe en zeggen dat hoewel het medicijn effectief is geweest in het verlagen van de amyloïdespiegels in de hersenen, het onduidelijk blijft of de resulterende vermindering van de cognitieve achteruitgang zal resulteren in klinisch relevante voordelen voor patiënten. Zij stellen dat de mogelijkheid van ernstige complicaties zoals bloedingen of zwellingen in de hersenen, veroorzaakt door een bijwerking genaamd amyloïde-gerelateerde beeldvormingseffecten (ARIA), hoewel klein, een groot probleem is. “Een redelijke beoordeling van de risico’s versus de voordelen van dit medicijn zou ertoe moeten leiden dat mensen zeer sceptisch worden”, zegt Matthew Schrag, een neuroloog aan de Vanderbilt Universiteit in Nashville, Tennessee.
Bescheiden effecten
Er is al lang gedebatteerd over de vraag of lecanemab, toegediend via een infuus, mensen klinisch betekenisvolle verminderingen van de cognitieve achteruitgang oplevert.
Een klinische fase III-studie met het medicijn, gepubliceerd in 2022, omvatte 1.795 mensen in de vroege stadia van de ziekte van Alzheimer en ontdekte dat degenen die het medicijn kregen na 18 maanden een vermindering van de cognitieve achteruitgang met 27% vertoonden vergeleken met degenen die een placebo kregen. Sommige onderzoekers vierden het nieuws als een overwinning voor het veld. Anderen voerden echter aan dat de effecten te klein zijn om een betekenisvolle impact op patiënten te hebben.
Een van de redenen voor dit verschil in perspectief is de manier waarop mensen naar de gegevens kijken, zegt Sebastian Walsh, onderzoeker op het gebied van de volksgezondheid aan de Universiteit van Cambridge, VK. De reductie van 27% vertegenwoordigt het relatieve verschil in de hoeveelheid cognitieve achteruitgang die de medicijngroep ervaart in vergelijking met de placebogroep. Het absolute verschil in cognitief functioneren is echter veel kleiner: 0,45 punten op een schaal van 18 punten. “Mensen kunnen uit de effectgrootte halen wat ze willen”, zegt Walsh. “Als ze het medicijn willen verkopen, kunnen ze zich concentreren op relatieve veranderingen – en als ze erg sceptisch zijn, kunnen ze praten over de absolute verschillen.”
Maar zelfs kleine effecten kunnen in de loop van de tijd aanzienlijk worden, vooral in de latere stadia van de ziekte, wanneer de afbraak sneller optreedt, zegt Walsh. “Uiteindelijk hangt het af van wat je denkt wat de impact op de lange termijn zal zijn, en daar hebben we geen antwoord op.”
Er zijn nu enkele langetermijngegevens beschikbaar. Op de Alzheimer Association International Conference (AAIC) in Philadelphia vorige maand presenteerden Eisai en Biogen de resultaten van een open-label extensieonderzoek dat patiënten bleef monitoren die lecanemab kregen na voltooiing van de Fase III-studie. Na drie jaar ononderbroken behandeling vertoonde meer dan de helft van de patiënten verbetering, en de meeste gevallen van ARIA deden zich voor in de eerste zes maanden van de behandeling. Ze meldden ook dat de mate van cognitieve achteruitgang terugkeerde naar het placeboniveau toen mensen stopten met het gebruik van het medicijn, zelfs als de amyloïde plaques waren verwijderd voordat de behandeling werd gestopt.
Sommigen zijn optimistisch over deze resultaten. Haass zegt dat het opwindend is om te zien dat het medicijn niet alleen amyloïde elimineert, maar ook de verspreiding van tau vertraagt, een ander eiwit dat zich ophoopt in de hersenen van mensen met de ziekte van Alzheimer. Anderen zijn voorzichtiger. Paresh Malhotra, een neuroloog aan het Imperial College London, wijst erop dat de positieve resultaten die bij AAIC werden gepresenteerd niet werden vergeleken met een placebo, dus er zijn meer gegevens nodig om de effectiviteit van het medicijn op de lange termijn te bepalen.
Ook de kosten zijn een zorg. Walsh zegt dat het gezien de bescheiden effecten van het medicijn moeilijk is om de kosten van het toedienen van het medicijn (die in de VS meer dan 20.000 dollar per jaar kost) en de vereiste procedures, zoals beeldvorming en genetische tests, te rechtvaardigen om te identificeren welke mensen in aanmerking komen om het te krijgen.
Veiligheidsproblemen
De grootste zorg met lecanemab is ARIA, waarvoor de Amerikaanse Food and Drug Administration (FDA) bij haar goedkeuring heeft gewaarschuwd. Hoewel de meeste gevallen asymptomatisch zijn - en er werden er geen gemeld tijdens de eerste 18 maanden durende klinische proef - waren er enkele ARIA-gerelateerde sterfgevallen in de verlengde fase van de studie.
Sommige deskundigen zeggen dat, hoewel het risico op ernstige ARIA laag is, het ook belangrijk is om te bedenken dat het medicijn in de vroegste stadia van de ziekte van Alzheimer wordt gegeven. “Dit is de periode waarin mensen het meeste te verliezen hebben”, zegt Schrag. “Tijdens deze periode moedigen we patiënten vaak aan om te reizen, na te denken over hun bucketlist en de dingen te bereiken die ze in het leven willen bereiken.”
Ellis van Etten, neuroloog aan het Leids Universitair Medisch Centrum in Nederland, zegt dat er nog steeds veel onbeantwoorde vragen zijn over ARIA en hoe artsen moeten reageren als ze zien dat patiënten deze afwijkingen ontwikkelen tijdens de behandeling. Bijvoorbeeld: Wie zal ernstige of levensbedreigende ARIA ontwikkelen? Op welk punt gaat ARIA van onschadelijk naar schadelijk en wanneer moet de behandeling met lecanemab worden stopgezet?
Veel van dezelfde vragen over de voordelen en risico's zijn ook van toepassing op een ander amyloïde-opruimend antilichaam, donanemab – gemaakt door Eli Lilly in Indianapolis, Indiana – dat in juli door de FDA werd goedgekeurd. Donanemab lijkt ongeveer dezelfde vermindering van cognitieve achteruitgang te bieden als lecanamab – en het is in verband gebracht met ARIA-gerelateerde sterfgevallen.
“We weten uit biomarkeronderzoek dat deze antilichamen amyloïde opruimen, dus we weten dat ze een fundamenteel mechanisme van de ziekte aanpakken”, zegt Malhotra. Maar deze medicijnen alleen zullen waarschijnlijk niet genoeg zijn, en het zal belangrijk zijn om ook andere aspecten van de ziekte aan te pakken. “Het is zeer waarschijnlijk dat we over tien jaar zullen praten over combinatietherapieën en dat de klaring van amyloïde deel zal uitmaken van die aanpak.”

 Suche
Suche
 Mein Konto
Mein Konto