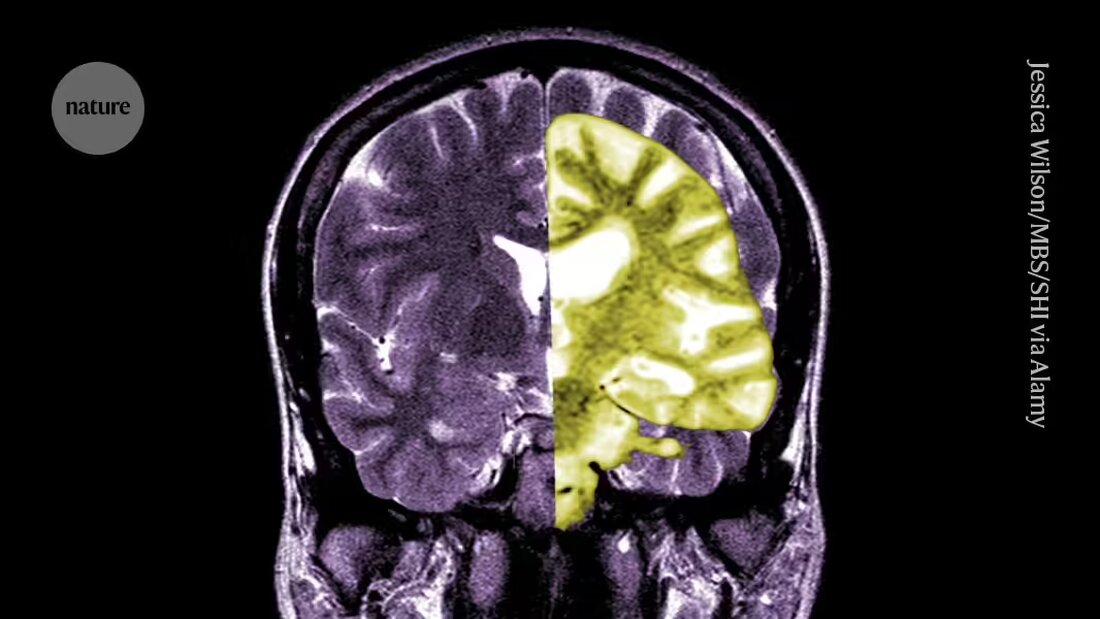
Pētnieku un klīnicistu vidū pastiprinās diskusijas par Alcheimera medikamentu lekanemabu - vienu no pirmajām zālēm, kas palēnina cilvēku kognitīvās spējas.
22. augustā Lielbritānijas Zāļu un veselības aprūpes produktu regulatīvā aģentūra deva zaļo gaismu šīm zālēm. Tomēr tajā pašā laikā Lielbritānijas veselības regulators NICE, kas nosaka, vai Lielbritānijas valsts finansētā Nacionālā veselības dienesta (NHS) pacientiem tiek piedāvātas zāles, projektā norādīja, ka lekanebabs NHS nebūs pieejams, jo ieguvumi ir pārāk mazi, lai attaisnotu augstās izmaksas.
"Neparasti ilgs laiks, ko viņi pavadīja, pārskatot zāles, liecina, ka tas nebija viegls vai vienkāršs lēmums," paziņojumā Zinātnes mediju centram Lielbritānijā sacīja psihiatrs Roberts Hovards no Londonas Universitātes koledžas.
ASV regulatori bija pirmie, kas apstiprināja šīs zāles 2023. gadā, un Eiropas Zāļu aģentūra (EMA) tagad pārskata savu lēmumu pēc zāļu ražotāja apelācijas.
Amiloīda mērķis
EMA lēmums saņēma arī pretrunīgu reakciju no Alcheimera kopienas. "Emocijas šeit patiešām ir augstas," saka bioķīmiķis Kristians Hāss no Ludviga Maksimiliāna universitātes Minhenē, Vācijā, kurš nepiekrīt lēmumam. "Tā ir pirmā slimību modificējošā zāle, kas mums ir bijusi vairāk nekā 30 gadu laikā." Saskaņā ar Hāsa teikto, liedzot pacientiem piekļuvi lekanemabam, daudzi zaudē iespēju iegūt vērtīgo laiku.
Lecanemab jeb Leqembi ir monoklonāla antiviela, kas iznīcina amiloīdu — vielu, kas Alcheimera slimības slimnieku smadzenēs veidojas toksiskās kuņģī. Zāles, ko ražo Eisai Tokijā un Biogen Kembridžā, Masačūsetsā, ir apstiprinātas arī Ķīnā, Japānā, Dienvidkorejā un Apvienotajos Arābu Emirātos.
Citi apsveic EMA, sakot, ka, lai gan zāles ir bijušas efektīvas amiloīda līmeņa samazināšanā smadzenēs, joprojām nav skaidrs, vai kognitīvā samazināšanās rezultātā radīsies klīniski nozīmīgi ieguvumi pacientiem. Viņi norāda, ka nopietnas bažas rada nopietnu komplikāciju iespējamība, piemēram, asiņošana vai smadzeņu pietūkums, ko izraisa blakusparādība, ko sauc par amiloīdu saistīto attēlveidošanas efektu (ARIA), lai gan tas ir mazs. "Saprātīgam šo zāļu riska un ieguvumu novērtējumam vajadzētu likt cilvēkiem būt ļoti skeptiskiem," saka Metjū Šrags, neirologs no Vanderbiltas universitātes Nešvilā, Tenesī.
Pieticīgi efekti
Tas, vai lekanemabs, ko ievada infūzijas veidā, nodrošina cilvēkiem klīniski nozīmīgu kognitīvās funkcijas samazināšanos, jau sen ir apspriests.
Šīs zāles III fāzes klīniskajā pētījumā, kas tika publicēts 2022. gadā, tika iekļauti 1795 cilvēki Alcheimera slimības sākuma stadijā, un tika konstatēts, ka tiem, kuri saņēma šīs zāles, pēc 18 mēnešiem kognitīvās funkcijas samazināšanās bija par 27%, salīdzinot ar tiem, kuri saņēma placebo. Daži pētnieki šīs ziņas atzīmēja kā lauka uzvaru. Tomēr citi apgalvoja, ka ietekme ir pārāk maza, lai būtiski ietekmētu pacientus.
Viens no šīs perspektīvas atšķirības iemesliem ir tas, kā cilvēki skatās uz datiem, saka Sebastians Volšs, sabiedrības veselības pētnieks no Kembridžas Universitātes Apvienotajā Karalistē. Samazinājums par 27% atspoguļo relatīvo atšķirību izziņas pasliktināšanās apjomā, ko piedzīvoja zāļu grupa, salīdzinot ar placebo grupu. Tomēr kognitīvo funkciju absolūtā atšķirība ir daudz mazāka: 0,45 punkti 18 punktu skalā. "Cilvēki no efekta lieluma var iegūt visu, ko vēlas," saka Volšs. "Ja viņi vēlas pārdot zāles, viņi varētu koncentrēties uz relatīvām izmaiņām - un, ja viņi ir ļoti skeptiski, viņi varētu runāt par absolūtām atšķirībām."
Bet pat neliela ietekme laika gaitā var kļūt nozīmīga, īpaši slimības vēlākajos posmos, kad degradācija notiek ātrāk, saka Volšs. "Galu galā tas ir atkarīgs no jūsu domām, kāda būs ilgtermiņa ietekme, un mums uz to nav atbildes."
Tagad ir pieejami daži ilgtermiņa dati. Alcheimera asociācijas starptautiskajā konferencē (AAIC) Filadelfijā pagājušajā mēnesī Eisai un Biogen iepazīstināja ar atklātā pagarinājuma pētījuma rezultātiem, kurā turpināja uzraudzīt pacientus, kuri saņēma lekanemabu pēc III fāzes pētījuma pabeigšanas. Pēc trīs gadus ilgas nepārtrauktas ārstēšanas vairāk nekā pusei pacientu novēroja uzlabošanos, un lielākā daļa ARIA gadījumu radās pirmajos sešos ārstēšanas mēnešos. Viņi arī ziņoja, ka izziņas samazināšanās ātrums atgriezās placebo līmenī, kad cilvēki pārtrauca lietot zāles, pat ja amiloīda plāksnes tika noņemtas pirms ārstēšanas pārtraukšanas.
Daži ir optimistiski par šiem rezultātiem – Hāss saka, ka ir aizraujoši redzēt, ka zāles ne tikai iznīcina amiloīdu, bet arī palēnina tau izplatīšanos, kas ir vēl viens proteīns, kas Alcheimera slimnieku smadzenēs uzkrājas kuņģī. Citi ir piesardzīgāki. Londonas Imperiālās koledžas neirologs Parešs Malhotra norāda, ka AAIC uzrādītie pozitīvie rezultāti netika salīdzināti ar placebo, tāpēc ir nepieciešams vairāk datu, lai noteiktu zāļu ilgtermiņa efektivitāti.
Bažas rada arī izmaksas. Volšs saka, ka, ņemot vērā zāļu pieticīgo iedarbību, ir grūti attaisnot zāļu lietošanas izmaksas (kas ASV maksā vairāk nekā 20 000 USD gadā) un nepieciešamās procedūras, piemēram, attēlveidošanu un ģenētisko testēšanu, lai identificētu personas, kas ir piemērotas to saņemšanai.
Drošības apsvērumi
Lielākās bažas par lekanemabu rada ARIA, par ko ASV Pārtikas un zāļu pārvalde (FDA) brīdināja savā apstiprinājumā. Lai gan lielākā daļa gadījumu ir asimptomātiski – un par tiem netika ziņots sākotnējā 18 mēnešu klīniskā pētījuma laikā, pētījuma pagarinātajā fāzē bija daži ar ARIA saistīti nāves gadījumi.
Daži eksperti saka, ka, lai gan smagas ARIA risks ir zems, ir svarīgi arī ņemt vērā, ka zāles tiek ievadītas Alcheimera slimības agrīnajā stadijā. "Šis ir periods, kurā cilvēkiem ir visvairāk ko zaudēt," saka Šrags. "Šajā logā mēs bieži mudinām pacientus ceļot, domāt par savu sarakstu un paveikt lietas, ko viņi vēlas paveikt dzīvē."
Leidenas Universitātes Medicīnas centra Nīderlandē neirologs Eliss van Ettens saka, ka joprojām ir daudz neatbildētu jautājumu par ARIA un to, kā ārstiem vajadzētu reaģēt, redzot, ka pacientiem ārstēšanas laikā attīstās šīs novirzes. Piemēram: kam attīstīsies nopietna vai dzīvībai bīstama ARIA? Kurā brīdī ARIA kļūst no nekaitīga par kaitīgu un kad jāpārtrauc ārstēšana ar lekanemabu?
Daudzi no tiem pašiem jautājumiem par ieguvumiem un riskiem attiecas arī uz citu amiloīdu attīrošo antivielu, donanemabu, ko ražoja Eli Lilly Indianapolisā, Indiānā, un kuru FDA apstiprināja jūlijā. Šķiet, ka Donanemabs nodrošina apmēram tādu pašu izziņas samazināšanos kā lekanamabs, un tas ir saistīts ar ARIA izraisītiem nāves gadījumiem.
"No biomarķieru darba mēs zinām, ka šīs antivielas attīra amiloīdu, tāpēc mēs zinām, ka tās risina slimības galveno mehānismu," saka Malhotra. Taču ar šīm zālēm vien, iespējams, nepietiks, un būs svarīgi pievērsties arī citiem slimības aspektiem. "Ir ļoti iespējams, ka pēc 10 gadiem mēs runāsim par kombinētām terapijām un ka amiloīda klīrenss būs daļa no šīs pieejas."

 Suche
Suche
 Mein Konto
Mein Konto