Il dibattito sul farmaco lecanemab per l'Alzheimer, uno dei primi farmaci in grado di rallentare il declino cognitivo nelle persone, si sta intensificando tra ricercatori e medici sulla questione se i potenziali benefici del trattamento superino i suoi rischi.
Il 22 agosto, l'Agenzia britannica per la regolamentazione dei medicinali e dei prodotti sanitari ha dato il via libera al farmaco. Allo stesso tempo, tuttavia, l’ente regolatore sanitario britannico NICE, che determina se i farmaci vengono offerti ai pazienti del Servizio sanitario nazionale (NHS), finanziato dallo stato britannico, ha affermato in una bozza che il lecanemab non sarebbe stato reso disponibile al NHS perché i benefici erano troppo piccoli per giustificare il costo elevato.
"Il tempo insolitamente lungo trascorso nella revisione del farmaco suggerisce che questa non è stata una decisione facile o semplice", ha detto lo psichiatra Robert Howard dell'University College di Londra in una dichiarazione al Science Media Center in Gran Bretagna.
Le autorità di regolamentazione statunitensi sono state le prime ad approvare il farmaco nel 2023 e l’Agenzia europea per i medicinali (EMA) sta ora rivedendo la sua decisione a seguito di un appello del produttore farmaceutico.
Bersaglio amiloide
La decisione dell'EMA ha ricevuto reazioni contrastanti anche da parte della comunità dell'Alzheimer. "Qui le emozioni sono davvero forti", afferma il biochimico Christian Haass dell'Università Ludwig Maximilians di Monaco, in Germania, che non è d'accordo con la decisione. “È il primo farmaco modificante la malattia che abbiamo in più di 30 anni”. Secondo Haass, negare ai pazienti l’accesso al lecanemab significa che molti perdono l’opportunità di guadagnare tempo prezioso.
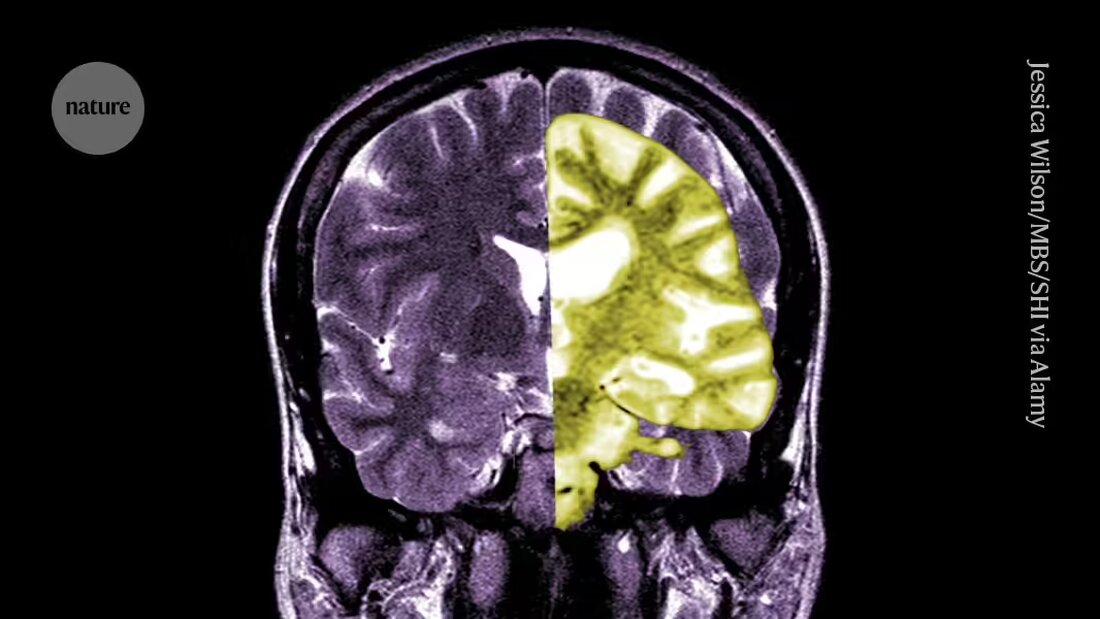
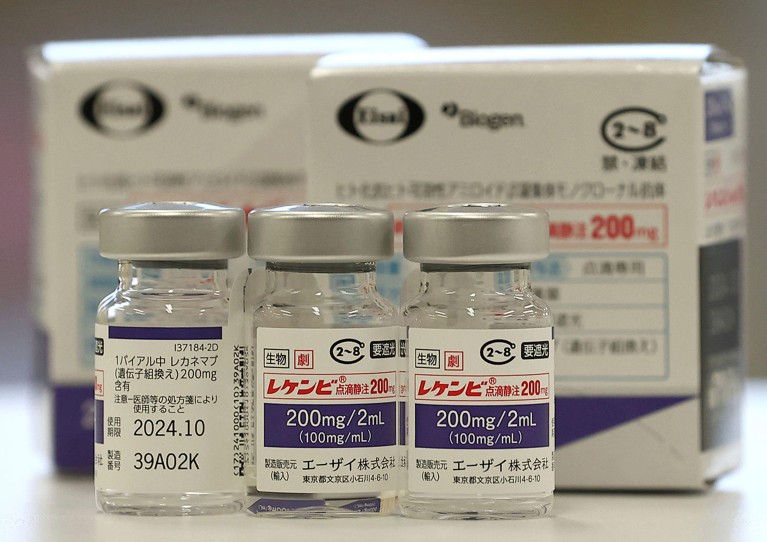
Lecanemab, o Leqembi, è un anticorpo monoclonale che elimina l'amiloide, una sostanza che si accumula in grumi tossici nel cervello delle persone con Alzheimer. Il farmaco, prodotto da Eisai a Tokyo e Biogen a Cambridge, Massachusetts, è approvato anche in Cina, Giappone, Corea del Sud ed Emirati Arabi Uniti.
Altri applaudono l’EMA, affermando che, sebbene il farmaco sia stato efficace nel ridurre i livelli di amiloide nel cervello, non è chiaro se la conseguente riduzione del declino cognitivo si tradurrà in benefici clinicamente rilevanti per i pazienti. Affermano che la possibilità di gravi complicazioni come sanguinamento o gonfiore nel cervello causato da un effetto collaterale chiamato effetti di imaging correlati all'amiloide (ARIA), sebbene piccola, è una delle principali preoccupazioni. "Una valutazione ragionevole dei rischi rispetto ai benefici di questo farmaco dovrebbe portare le persone a essere molto scettiche", afferma Matthew Schrag, neurologo della Vanderbilt University di Nashville, nel Tennessee.
Effetti modesti
È stato a lungo dibattuto se lecanemab somministrato per infusione fornisca alle persone riduzioni clinicamente significative del declino cognitivo.
Uno studio clinico di fase III sul farmaco, pubblicato nel 2022, ha incluso 1.795 persone nelle prime fasi della malattia di Alzheimer e ha scoperto che coloro che hanno ricevuto il farmaco hanno mostrato una riduzione del declino cognitivo del 27% dopo 18 mesi rispetto a coloro che hanno ricevuto un placebo. Alcuni ricercatori hanno celebrato la notizia come una vittoria per il settore. Tuttavia, altri sostengono che gli effetti sono troppo piccoli per avere un impatto significativo sui pazienti.
Uno dei motivi di questa differenza di prospettiva è il modo in cui le persone guardano i dati, afferma Sebastian Walsh, ricercatore di sanità pubblica presso l’Università di Cambridge, nel Regno Unito. La riduzione del 27% rappresenta la differenza relativa nella quantità di declino cognitivo sperimentato dal gruppo trattato con il farmaco rispetto al gruppo placebo. Tuttavia, la differenza assoluta nella funzione cognitiva è molto più piccola: 0,45 punti su una scala di 18 punti. "Le persone possono estrarre ciò che vogliono dalla dimensione dell'effetto", afferma Walsh. “Se vogliono vendere il farmaco, potrebbero concentrarsi sui cambiamenti relativi – e se sono molto scettici, potrebbero parlare delle differenze assolute”.
Ma anche piccoli effetti possono diventare significativi nel tempo, in particolare nelle fasi successive della malattia, quando il degrado avviene più rapidamente, afferma Walsh. “In definitiva dipende da cosa pensi quale sarà l’impatto a lungo termine, e non abbiamo una risposta a questo.”
Alcuni dati a lungo termine sono ora disponibili. Alla conferenza internazionale dell'Alzheimer Association (AAIC) tenutasi a Filadelfia il mese scorso, Eisai e Biogen hanno presentato i risultati di uno studio di estensione in aperto che ha continuato a monitorare i pazienti che avevano ricevuto lecanemab dopo il completamento dello studio di Fase III. Dopo tre anni di trattamento continuo, più della metà dei pazienti ha mostrato un miglioramento e la maggior parte dei casi di ARIA si sono verificati nei primi sei mesi di trattamento. Hanno anche riferito che il tasso di declino cognitivo è tornato ai livelli del placebo quando le persone hanno smesso di assumere il farmaco, anche se le placche amiloidi erano state rimosse prima dell’interruzione del trattamento.
Alcuni sono ottimisti riguardo a questi risultati: Haass dice che è emozionante vedere che il farmaco non solo elimina l'amiloide, ma rallenta anche la diffusione della tau, un'altra proteina che si accumula in grumi nel cervello delle persone con Alzheimer. Altri sono più cauti. Paresh Malhotra, neurologo dell'Imperial College di Londra, sottolinea che i risultati positivi presentati all'AAIC non sono stati confrontati con un placebo, quindi sono necessari più dati per determinare l'efficacia a lungo termine del farmaco.
Anche il costo è una preoccupazione. Walsh afferma che, considerati gli effetti modesti del farmaco, è difficile giustificare il costo di somministrazione del farmaco (che costa più di 20.000 dollari all’anno negli Stati Uniti) e le procedure necessarie, come l’imaging e i test genetici, per identificare le persone idonee a riceverlo.
Preoccupazioni per la sicurezza
La più grande preoccupazione riguardo al lecanemab è l’ARIA, da cui la Food and Drug Administration (FDA) statunitense ha messo in guardia nella sua approvazione. Sebbene la maggior parte dei casi siano asintomatici – e non ne sia stato segnalato nessuno durante lo studio clinico iniziale di 18 mesi – si sono verificati alcuni decessi correlati all’ARIA nella fase estesa dello studio.
Alcuni esperti affermano che, sebbene il rischio di ARIA grave sia basso, è anche importante considerare che il farmaco viene somministrato nelle prime fasi dell'Alzheimer. “Questo è il periodo in cui le persone hanno più da perdere”, afferma Schrag. "Durante questo periodo, spesso incoraggiamo i pazienti a viaggiare, a pensare alla loro lista dei desideri e a realizzare le cose che desiderano realizzare nella vita."
Ellis van Etten, neurologo del Leiden University Medical Center nei Paesi Bassi, afferma che ci sono ancora molte domande senza risposta sull'ARIA e su come i medici dovrebbero rispondere quando vedono pazienti che sviluppano queste anomalie durante il trattamento. Ad esempio: chi svilupperà un'ARIA grave o pericolosa per la vita? A che punto l’ARIA passa da innocua a dannosa e quando si dovrebbe interrompere il trattamento con lecanemab?
Molte delle stesse domande su benefici e rischi si applicano anche a un altro anticorpo che elimina l’amiloide, donanemab – prodotto da Eli Lilly a Indianapolis, Indiana – che è stato approvato dalla FDA a luglio. Donanemab sembra fornire all’incirca la stessa riduzione del declino cognitivo di lecanamab – ed è stato collegato a decessi correlati all’ARIA.
"Sappiamo dal lavoro sui biomarcatori che questi anticorpi eliminano l'amiloide, quindi sappiamo che affrontano un meccanismo fondamentale della malattia", afferma Malhotra. Ma questi farmaci da soli probabilmente non saranno sufficienti e sarà importante affrontare anche altri aspetti della malattia. “È molto probabile che tra 10 anni si parlerà di terapie combinate e che l’eliminazione dell’amiloide farà parte di tale approccio”.

 Suche
Suche
 Mein Konto
Mein Konto