A kutatók és a klinikusok körében felerősödik a vita a lecanemab Alzheimer-kór gyógyszeréről – az egyik első olyan gyógyszerről, amely lassítja az emberek kognitív hanyatlását –, hogy a kezelés lehetséges előnyei meghaladják-e a kockázatokat.
Augusztus 22-én a brit Gyógyszer- és Egészségügyi Termékek Szabályozó Ügynöksége zöld utat adott a gyógyszernek. Ugyanakkor a brit egészségügyi szabályozó hatóság, a NICE, amely meghatározza, hogy a brit államilag finanszírozott Nemzeti Egészségügyi Szolgálat (NHS) keretében kínálnak-e gyógyszereket a betegeknek, egy tervezetben kijelentette, hogy a lecanemabot nem teszik elérhetővé az NHS-ben, mert az előnyök túl kicsik ahhoz, hogy indokolják a magas költségeket.
"A szokatlanul hosszú idő, amit a gyógyszer felülvizsgálatával töltöttek, arra utal, hogy ez nem volt könnyű vagy egyszerű döntés" - mondta Robert Howard, a University College London pszichiátere a brit Science Media Centernek adott nyilatkozatában.
Az amerikai szabályozó hatóságok 2023-ban elsőként hagyták jóvá a gyógyszert, az Európai Gyógyszerügynökség (EMA) pedig most vizsgálja felül döntését a gyógyszergyártó fellebbezése nyomán.
Amiloid célpont
Az EMA döntése vegyes reakciókat váltott ki az Alzheimer-kór közösségéből is. „Az érzelmek valóban felpörögnek itt” – mondja Christian Haass biokémikus, a müncheni Ludwig Maximilians Egyetem munkatársa, aki nem ért egyet a döntéssel. "Több mint 30 éve ez az első betegségmódosító gyógyszerünk." Haass szerint, ha megtagadják a betegektől a lekanemabhoz való hozzáférést, sokan elveszítik a lehetőséget, hogy értékes időt nyerjenek.
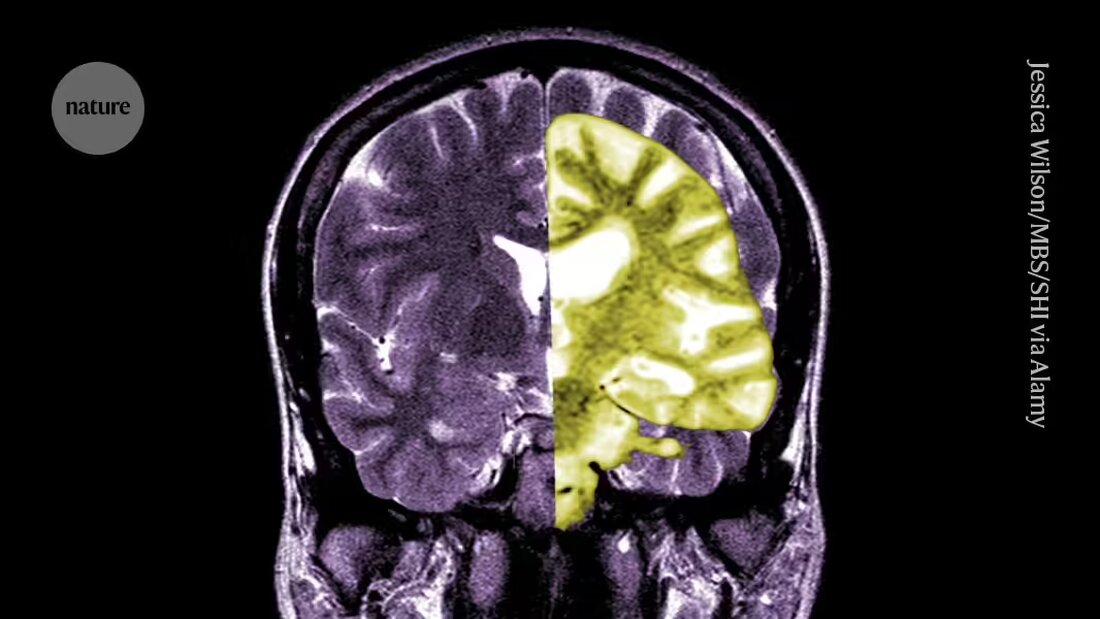
A Lecanemab vagy Leqembi egy monoklonális antitest, amely eltávolítja az amiloidot, egy olyan anyagot, amely mérgező csomókká halmozódik fel az Alzheimer-kórban szenvedők agyában. A tokiói Eisai és a massachusettsi Cambridge-ben a Biogen által gyártott gyógyszer Kínában, Japánban, Dél-Koreában és az Egyesült Arab Emírségekben is engedélyezett.
Mások üdvözlik az EMA-t, mondván, hogy bár a gyógyszer hatékonyan csökkentette az amiloidszintet az agyban, továbbra sem világos, hogy a kognitív hanyatlás ebből eredő csökkenése klinikailag releváns előnyökkel jár-e a betegek számára. Azt állítják, hogy az amyloid-kapcsolódó képalkotó hatások (ARIA) nevű mellékhatás által okozott súlyos szövődmények, például vérzés vagy duzzanat az agyban, bár kicsi, komoly aggodalomra ad okot. "A gyógyszer kockázatainak és előnyeinek ésszerű értékelése nagyon szkeptikussá teheti az embereket" - mondja Matthew Schrag, a Tennessee állambeli Nashville-i Vanderbilt Egyetem neurológusa.
Szerény hatások
Régóta vita tárgyát képezi, hogy az infúzióban adott lecanemab klinikailag jelentős mértékben csökkenti-e a kognitív hanyatlást.
A gyógyszer 2022-ben közzétett III. fázisú klinikai vizsgálata során 1795 ember vett részt az Alzheimer-kór korai stádiumában, és azt találta, hogy azok, akik ezt a gyógyszert kapták, 18 hónap után 27%-kal csökkentették a kognitív hanyatlást, összehasonlítva azokkal, akik placebót kaptak. Egyes kutatók a hírt a mezőny győzelmeként ünnepelték. Mások azonban azzal érveltek, hogy a hatások túl kicsik ahhoz, hogy jelentős hatást gyakoroljanak a betegekre.
A perspektívabeli különbségek egyik oka az, hogy az emberek hogyan tekintenek az adatokra, mondja Sebastian Walsh, a Cambridge-i Egyetem közegészségügyi kutatója. A 27%-os csökkenés a relatív különbséget jelenti a kognitív hanyatlás mértékében, amelyet a gyógyszercsoport tapasztalt a placebocsoporthoz képest. A kognitív funkciók abszolút különbsége azonban sokkal kisebb: 0,45 pont egy 18 pontos skálán. „Az emberek bármit kivonhatnak a hatás méretéből, amit akarnak” – mondja Walsh. "Ha el akarják adni a gyógyszert, akkor a relatív változásokra összpontosíthatnak – és ha nagyon szkeptikusak, akkor beszélhetnek az abszolút különbségekről."
De még a kis hatások is jelentőssé válhatnak idővel, különösen a betegség későbbi szakaszaiban, amikor a lebomlás gyorsabban megy végbe, mondja Walsh. "Végső soron attól függ, hogy mit gondol, milyen hosszú távú hatása lesz, és erre nincs válaszunk."
Néhány hosszú távú adat már elérhető. Az Alzheimer Szövetség Nemzetközi Konferenciáján (AAIC) Philadelphiában a múlt hónapban Eisai és Biogen egy nyílt elrendezésű kiterjesztett vizsgálat eredményeit mutatta be, amely a III. fázisú vizsgálat befejezése után folytatta a lecanemabot kapó betegek monitorozását. Három év folyamatos kezelés után a betegek több mint felénél javulás mutatkozott, és a legtöbb ARIA eset a kezelés első hat hónapjában fordult elő. Beszámoltak arról is, hogy a kognitív hanyatlás aránya visszatért a placebo szintre, amikor az emberek abbahagyták a gyógyszer szedését, még akkor is, ha az amiloid plakkokat a kezelés leállítása előtt eltávolították.
Vannak, akik optimistán tekintenek ezekre az eredményekre – Haass szerint izgalmas látni, hogy a gyógyszer nemcsak az amiloidot távolítja el, hanem lassítja a tau terjedését is, egy másik fehérje, amely csomókká halmozódik fel az Alzheimer-kórban szenvedők agyában. Mások óvatosabbak. Paresh Malhotra, a londoni Imperial College neurológusa rámutat, hogy az AAIC-n bemutatott pozitív eredményeket nem hasonlították össze a placebóval, ezért több adatra van szükség a gyógyszer hosszú távú hatékonyságának meghatározásához.
A költségek is aggodalomra adnak okot. Walsh szerint a szer szerény hatásai miatt nehéz megindokolni a gyógyszer beadásának költségeit (amely az Egyesült Államokban évente több mint 20 000 dollárba kerül) és a szükséges eljárásokat, például a képalkotást és a genetikai vizsgálatot, hogy azonosítsák a gyógyszer szedésére jogosult személyeket.
Biztonsági aggályok
A lekanemabbal kapcsolatos legnagyobb gond az ARIA, amelyre az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága (FDA) figyelmeztetett jóváhagyásában. Bár a legtöbb eset tünetmentes – és egyikről sem számoltak be a kezdeti 18 hónapos klinikai vizsgálat során – előfordult néhány ARIA-val összefüggő haláleset a vizsgálat kiterjesztett szakaszában.
Egyes szakértők szerint bár a súlyos ARIA kockázata alacsony, azt is fontos figyelembe venni, hogy a gyógyszert az Alzheimer-kór legkorábbi stádiumában adják. „Ez az az időszak, amikor az embereknek van a legtöbb vesztenivalójuk” – mondja Schrag. „Ebben az ablakban gyakran arra biztatjuk a betegeket, hogy utazzanak, gondolják át a bucket listát, és valósítsák meg azokat a dolgokat, amelyeket el szeretnének érni az életben.”
Ellis van Etten, a hollandiai Leideni Egyetem Orvosi Központjának neurológusa szerint még mindig sok megválaszolatlan kérdés van az ARIA-val kapcsolatban, és arról, hogyan reagáljanak az orvosok, ha azt látják, hogy a betegeknél ezek a rendellenességek a kezelés során kialakulnak. Például: Kinél alakul ki súlyos vagy életveszélyes ARIA? Mikor válik az ARIA ártalmatlanból károssá, és mikor kell leállítani a lecanemab-kezelést?
Ugyanezek az előnyökkel és kockázatokkal kapcsolatos kérdések egy másik amiloid-tisztító antitestre, a donanemabra is vonatkoznak – amelyet Eli Lilly készített Indianapolisban, Indiana államban –, amelyet az FDA júliusban hagyott jóvá. Úgy tűnik, hogy a donanemab körülbelül ugyanolyan mértékben csökkenti a kognitív hanyatlást, mint a lekanamab – és összefüggésbe hozták az ARIA-val kapcsolatos halálesetekkel.
„A biomarkerekkel végzett munkából tudjuk, hogy ezek az antitestek megtisztítják az amiloidot, tehát tudjuk, hogy a betegség egyik alapvető mechanizmusát célozzák” – mondja Malhotra. De ezek a gyógyszerek önmagukban valószínűleg nem lesznek elegendőek, és fontos lesz a betegség egyéb vonatkozásaival is foglalkozni. "Nagyon valószínű, hogy 10 év múlva kombinált terápiákról fogunk beszélni, és az amiloid clearance része lesz ennek a megközelítésnek."

 Suche
Suche
 Mein Konto
Mein Konto