Keskustelu Alzheimerin lääkkeestä lekanemabista - yksi ensimmäisistä lääkkeistä, jotka hidastavat ihmisten kognitiivista heikkenemistä - kiihtyvät tutkijoiden ja kliinikkojen keskuudessa siitä, ovatko hoidon mahdolliset hyödyt sen riskejä suuremmat.
Britannian lääke- ja terveysalan tuotteiden sääntelyvirasto antoi lääkkeelle vihreää valoa 22. elokuuta. Samaan aikaan Ison-Britannian terveydenhuollon sääntelyviranomainen NICE, joka määrittää, tarjotaanko potilaille lääkkeitä Britannian valtion rahoittaman National Health Servicen (NHS) kautta, sanoi luonnoksessa, että lekanemabia ei annettaisi NHS:n saataville, koska hyödyt olivat liian pieniä oikeuttamaan korkeita kustannuksia.
"Epätavallisen pitkä aika, jonka he käyttivät lääkkeen tarkistamiseen, viittaa siihen, että tämä ei ollut helppo tai yksinkertainen päätös", sanoi psykiatri Robert Howard University College Londonista Britannian Science Media Centerille antamassaan lausunnossa.
Yhdysvaltain sääntelyviranomaiset hyväksyivät lääkkeen ensimmäisinä vuonna 2023, ja Euroopan lääkevirasto (EMA) tarkistaa nyt päätöstään lääkevalmistajan valituksen johdosta.
Amyloidikohde
EMA:n päätös sai myös ristiriitaisia reaktioita Alzheimerin yhteisössä. "Tunteet ovat täällä todella korkealla", sanoo biokemisti Christian Haass Ludwig Maximiliansin yliopistosta Münchenistä, Saksasta, joka on eri mieltä päätöksestä. "Se on ensimmäinen sairautta modifioiva lääke, joka meillä on ollut yli 30 vuoteen." Haassin mukaan potilaiden pääsyn estäminen lekanemabille tarkoittaa, että monet menettävät mahdollisuuden saada arvokasta aikaa.
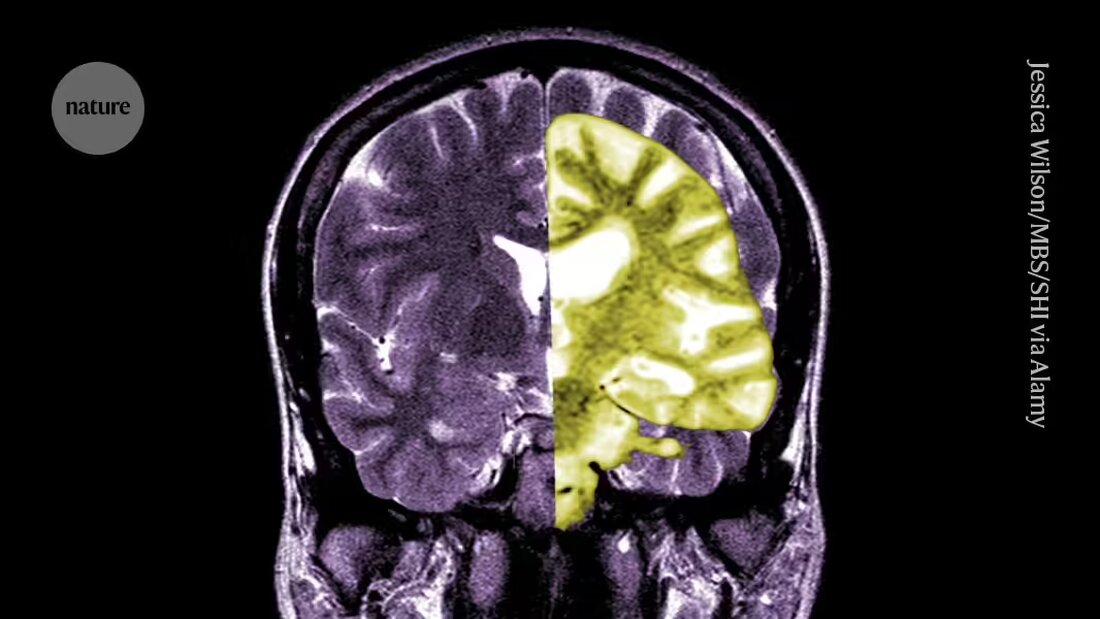
Lecanemab tai Leqembi on monoklonaalinen vasta-aine, joka eliminoi amyloidin, aineen, joka kerääntyy myrkyllisiksi kokkareiksi Alzheimerin tautia sairastavien ihmisten aivoihin. Eisain Tokiossa ja Biogenin Cambridgessa Massachusettsissa valmistama lääke on hyväksytty myös Kiinassa, Japanissa, Etelä-Koreassa ja Yhdistyneissä arabiemiirikunnissa.
Toiset kiittävät EMA:ta sanoen, että vaikka lääke on alentanut tehokkaasti amyloiditasoja aivoissa, on epäselvää, johtaako kognitiivisen heikkenemisen väheneminen kliinisesti merkittäviin hyötyihin potilaille. He toteavat, että amyloidiin liittyvien kuvantamisvaikutusten (ARIA) aiheuttamien vakavien komplikaatioiden, kuten verenvuodon tai aivojen turvotuksen, mahdollisuus, vaikka se on pieni, on suuri huolenaihe. "Tämän lääkkeen riskien ja hyötyjen kohtuullinen arvio saa ihmiset olemaan hyvin skeptisiä", sanoo Matthew Schrag, neurologi Vanderbiltin yliopistosta Nashvillessä, Tennesseen osavaltiossa.
Vaatimattomia tehosteita
Siitä, vähentääkö infuusiona annettu lekanemabi kliinisesti merkittävää kognitiivista heikkenemistä, on keskusteltu pitkään.
Lääkkeen vuonna 2022 julkaistu vaiheen III kliininen tutkimus, johon osallistui 1 795 Alzheimerin taudin alkuvaiheessa olevaa ihmistä, havaitsi, että lääkettä saaneiden kognitiivinen heikkeneminen väheni 27 % 18 kuukauden jälkeen verrattuna lumelääkettä saaneisiin. Jotkut tutkijat juhlivat uutista alan voittona. Toiset kuitenkin väittivät, että vaikutukset ovat liian pieniä, jotta niillä olisi merkittävä vaikutus potilaisiin.
Yksi syy tähän eroon on se, miten ihmiset tarkastelevat tietoja, sanoo Sebastian Walsh, kansanterveystutkija Cambridgen yliopistosta Iso-Britanniasta. 27 prosentin vähennys edustaa suhteellista eroa lääkeryhmän kokeman kognitiivisen heikkenemisen määrässä lumelääkeryhmään verrattuna. Kognitiivisen toiminnan absoluuttinen ero on kuitenkin paljon pienempi: 0,45 pistettä 18 pisteen asteikolla. "Ihmiset voivat poimia tehosteen koosta mitä haluavat", Walsh sanoo. "Jos he haluavat myydä lääkettä, he voivat keskittyä suhteellisiin muutoksiin – ja jos he ovat hyvin skeptisiä, he voivat puhua absoluuttisista eroista."
Mutta pienetkin vaikutukset voivat tulla merkittäviksi ajan myötä, erityisesti taudin myöhemmissä vaiheissa, kun hajoaminen tapahtuu nopeammin, Walsh sanoo. "Loppujen lopuksi se riippuu siitä, mitä ajattelet pitkän aikavälin vaikutuksista, eikä meillä ole siihen vastausta."
Joitakin pitkän aikavälin tietoja on nyt saatavilla. Eisai ja Biogen esittelivät viime kuussa Philadelphiassa järjestetyssä Alzheimer Associationin kansainvälisessä konferenssissa (AAIC) tuloksia avoimesta jatkotutkimuksesta, jossa jatkettiin lekanemabia saaneiden potilaiden seurantaa vaiheen III tutkimuksen päätyttyä. Kolmen vuoden jatkuvan hoidon jälkeen yli puolet potilaista osoitti paranemista, ja suurin osa ARIA-tapauksista ilmaantui kuuden ensimmäisen hoitokuukauden aikana. He raportoivat myös, että kognitiivisen heikkenemisen nopeus palasi lumelääketasolle, kun ihmiset lopettivat lääkkeen käytön, vaikka amyloidiplakit olisi poistettu ennen hoidon lopettamista.
Jotkut ovat optimistisia näistä tuloksista - Haass sanoo, että on jännittävää nähdä, että lääke ei ainoastaan eliminoi amyloidia, vaan myös hidastaa tau:n leviämistä, toisen proteiinin, joka muodostuu kokkareiksi Alzheimerin tautia sairastavien ihmisten aivoihin. Toiset ovat varovaisempia. Imperial College Londonin neurologi Paresh Malhotra huomauttaa, että AAIC:ssa esitettyjä positiivisia tuloksia ei verrattu lumelääkkeeseen, joten tarvitaan lisää tietoa lääkkeen pitkän aikavälin tehokkuuden määrittämiseksi.
Myös hinta huolestuttaa. Walsh sanoo, että ottaen huomioon lääkkeen vaatimattomat vaikutukset, on vaikea perustella lääkkeen antokustannuksia (joka maksaa Yhdysvalloissa yli 20 000 dollaria vuodessa) ja tarvittavia toimenpiteitä, kuten kuvantamista ja geneettistä testausta, jotta voidaan tunnistaa kelvolliset ihmiset sen saamiseen.
Turvallisuusnäkökohdat
Suurin huolenaihe lekanemabin suhteen on ARIA, josta Yhdysvaltain elintarvike- ja lääkevirasto (FDA) varoitti hyväksynnässään. Vaikka useimmat tapaukset ovat oireettomia - eikä yhtään raportoitu ensimmäisen 18 kuukauden kliinisen tutkimuksen aikana - tutkimuksen pidennetyssä vaiheessa oli joitain ARIAan liittyviä kuolemantapauksia.
Jotkut asiantuntijat sanovat, että vaikka vakavan ARIA:n riski on pieni, on myös tärkeää ottaa huomioon, että lääke annetaan Alzheimerin taudin varhaisissa vaiheissa. "Tämä on ajanjakso, jolloin ihmisillä on eniten menetettävää", Schrag sanoo. "Tämän ikkunan aikana rohkaisemme potilaita usein matkustamaan, miettimään bucket-listaansa ja saavuttamaan asioita, joita he haluavat saavuttaa elämässään."
Alankomaiden Leidenin yliopiston lääketieteellisen keskuksen neurologi Ellis van Etten sanoo, että ARIAsta ja siitä, miten lääkäreiden tulisi reagoida, on edelleen monia vastaamattomia kysymyksiä, kun he näkevät potilaiden kehittyvän näitä poikkeavuuksia hoidon aikana. Esimerkiksi: Kenelle kehittyy vakava tai hengenvaarallinen ARIA? Missä vaiheessa ARIA muuttuu vaarattomasta haitalliseksi ja milloin lekanemabihoito tulee lopettaa?
Monet samoista etuja ja riskejä koskevista kysymyksistä pätevät myös toiseen amyloidia poistavaan vasta-aineeseen, donanemabiin, jonka valmistaa Eli Lilly Indianapolisissa, Indianassa, ja jonka FDA hyväksyi heinäkuussa. Donanemabi näyttää vähentävän suunnilleen samanlaista kognitiivista heikkenemistä kuin lekanamabi – ja se on yhdistetty ARIAan liittyviin kuolemiin.
"Tiedämme biomarkkerityöstä, että nämä vasta-aineet poistavat amyloidin, joten tiedämme, että ne käsittelevät taudin perusmekanismia", Malhotra sanoo. Mutta nämä lääkkeet eivät todennäköisesti yksinään riitä, ja on tärkeää käsitellä myös muita taudin näkökohtia. "On hyvin todennäköistä, että 10 vuoden kuluttua puhumme yhdistelmähoidoista ja että amyloidin puhdistuma on osa tätä lähestymistapaa."

 Suche
Suche
 Mein Konto
Mein Konto