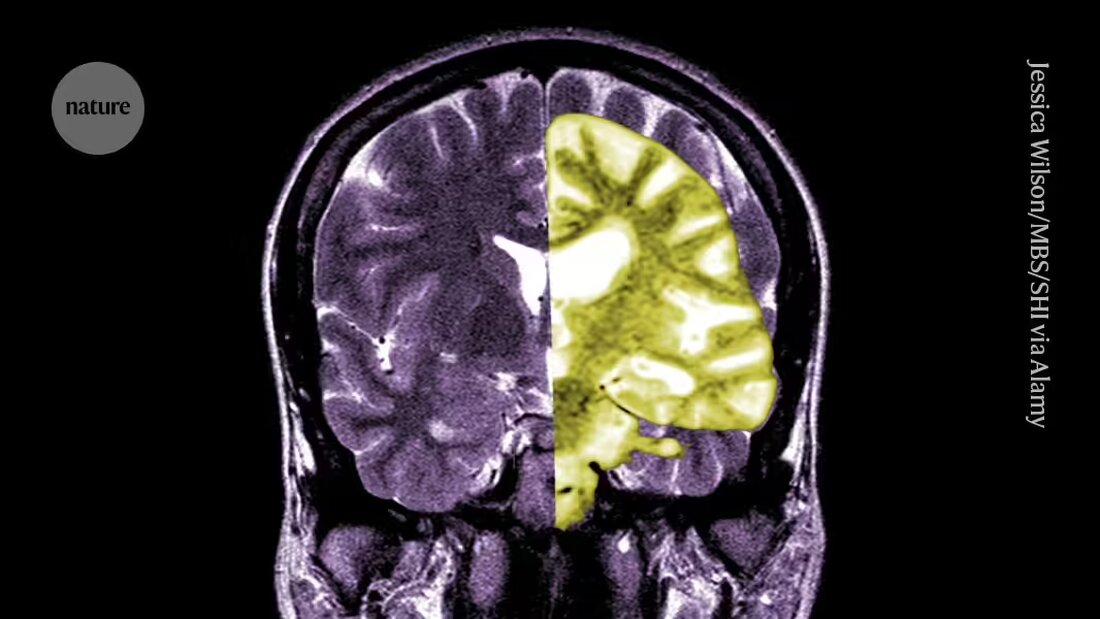
El debate sobre el medicamento contra el Alzheimer lecanemab, uno de los primeros fármacos que retarda el deterioro cognitivo en las personas, se está intensificando entre investigadores y médicos sobre si los beneficios potenciales del tratamiento superan sus riesgos.
El 22 de agosto, la Agencia Reguladora de Medicamentos y Productos Sanitarios de Gran Bretaña dio luz verde al medicamento. Al mismo tiempo, sin embargo, el regulador de salud británico NICE, que determina si los medicamentos se ofrecen a los pacientes en el Servicio Nacional de Salud (NHS), financiado por el estado británico, dijo en un borrador que lecanemab no estaría disponible en el NHS porque los beneficios eran demasiado pequeños para justificar el alto costo.
"El tiempo inusualmente largo que dedicaron a revisar el fármaco sugiere que no fue una decisión fácil ni sencilla", dijo el psiquiatra Robert Howard del University College de Londres en una declaración al Science Media Center de Gran Bretaña.
Los reguladores estadounidenses fueron los primeros en aprobar el medicamento en 2023, y la Agencia Europea de Medicamentos (EMA) está revisando ahora su decisión tras una apelación del fabricante de medicamentos.
Objetivo amiloide
La decisión de la EMA también generó reacciones encontradas por parte de la comunidad de Alzheimer. “Aquí las emociones están realmente a flor de piel”, dice el bioquímico Christian Haass de la Universidad Ludwig Maximilians de Múnich, Alemania, que no está de acuerdo con la decisión. "Es el primer fármaco modificador de enfermedades que hemos tenido en más de 30 años". Según Haass, negar a los pacientes el acceso a lecanemab significa que muchos pierden la oportunidad de ganar un tiempo valioso.
Lecanemab, o Leqembi, es un anticuerpo monoclonal que elimina el amiloide, una sustancia que se acumula en grumos tóxicos en el cerebro de las personas con Alzheimer. El fármaco, fabricado por Eisai en Tokio y Biogen en Cambridge, Massachusetts, también está aprobado en China, Japón, Corea del Sur y los Emiratos Árabes Unidos.
Otros aplauden a la EMA y dicen que, si bien el fármaco ha sido eficaz para reducir los niveles de amiloide en el cerebro, aún no está claro si la reducción resultante del deterioro cognitivo se traducirá en beneficios clínicamente relevantes para los pacientes. Afirman que la posibilidad de complicaciones graves, como sangrado o hinchazón en el cerebro causada por un efecto secundario llamado efectos de imagen relacionados con amiloide (ARIA), aunque pequeña, es una preocupación importante. "Una evaluación razonable de los riesgos y beneficios de este fármaco debería llevar a la gente a ser muy escéptica", afirma Matthew Schrag, neurólogo de la Universidad de Vanderbilt en Nashville, Tennessee.
Efectos modestos
Durante mucho tiempo se ha debatido si lecanemab administrado mediante infusión proporciona a las personas reducciones clínicamente significativas en el deterioro cognitivo.
Un ensayo clínico de fase III del fármaco, publicado en 2022, incluyó a 1.795 personas en las primeras etapas de la enfermedad de Alzheimer y encontró que quienes recibieron el fármaco mostraron una reducción del 27% en el deterioro cognitivo después de 18 meses en comparación con quienes recibieron un placebo. Algunos investigadores celebraron la noticia como una victoria del campo. Sin embargo, otros argumentaron que los efectos son demasiado pequeños para tener un impacto significativo en los pacientes.
Una de las razones de esta diferencia de perspectiva es la forma en que la gente ve los datos, dice Sebastian Walsh, investigador de salud pública de la Universidad de Cambridge, Reino Unido. La reducción del 27% representa la diferencia relativa en la cantidad de deterioro cognitivo experimentado por el grupo de fármaco en comparación con el grupo de placebo. Sin embargo, la diferencia absoluta en la función cognitiva es mucho menor: 0,45 puntos en una escala de 18 puntos. "La gente puede extraer lo que quiera del tamaño del efecto", dice Walsh. "Si quieren vender el medicamento, podrían centrarse en los cambios relativos, y si son muy escépticos, podrían hablar de las diferencias absolutas".
Pero incluso los efectos pequeños pueden volverse significativos con el tiempo, particularmente en las últimas etapas de la enfermedad, cuando la degradación ocurre más rápidamente, dice Walsh. "En última instancia, depende de lo que uno piense cuál será el impacto a largo plazo, y no tenemos una respuesta para eso".
Algunos datos a largo plazo ya están disponibles. En la Conferencia Internacional de la Asociación Alzheimer (AAIC) celebrada en Filadelfia el mes pasado, Eisai y Biogen presentaron los resultados de un estudio de extensión abierto que continuó monitoreando a los pacientes que recibieron lecanemab después de completar el ensayo de Fase III. Después de tres años de tratamiento continuo, más de la mitad de los pacientes mostraron mejoría y la mayoría de los casos de ARIA ocurrieron en los primeros seis meses de tratamiento. También informaron que la tasa de deterioro cognitivo volvió a los niveles de placebo cuando las personas dejaron de tomar el medicamento, incluso si las placas amiloides se habían eliminado antes de suspender el tratamiento.
Algunos son optimistas acerca de estos resultados: Haass dice que es emocionante ver que el medicamento no sólo elimina el amiloide, sino que también retarda la propagación de tau, otra proteína que se acumula en el cerebro de las personas con Alzheimer. Otros son más cautelosos. Paresh Malhotra, neurólogo del Imperial College de Londres, señala que los resultados positivos presentados en la AAIC no se compararon con un placebo, por lo que se necesitan más datos para determinar la eficacia a largo plazo del fármaco.
El costo también es una preocupación. Walsh dice que, dados los modestos efectos del fármaco, es difícil justificar el costo de administrarlo (que cuesta más de 20.000 dólares al año en Estados Unidos) y los procedimientos necesarios, como imágenes y pruebas genéticas, para identificar a las personas elegibles para recibirlo.
Preocupaciones de seguridad
La mayor preocupación con lecanemab es el ARIA, sobre el cual la Administración de Alimentos y Medicamentos de EE. UU. (FDA) advirtió en su aprobación. Aunque la mayoría de los casos son asintomáticos (y no se informó ninguno durante el ensayo clínico inicial de 18 meses), hubo algunas muertes relacionadas con ARIA en la fase ampliada del estudio.
Algunos expertos dicen que aunque el riesgo de ARIA grave es bajo, también es importante considerar que el medicamento se administra en las primeras etapas del Alzheimer. "Este es el período en el que la gente tiene más que perder", afirma Schrag. "Durante este período, a menudo animamos a los pacientes a viajar, pensar en su lista de deseos y lograr las cosas que quieren lograr en la vida".
Ellis van Etten, neurólogo del Centro Médico de la Universidad de Leiden en los Países Bajos, dice que todavía hay muchas preguntas sin respuesta sobre ARIA y cómo deben responder los médicos cuando ven que los pacientes desarrollan estas anomalías durante el tratamiento. Por ejemplo: ¿Quién desarrollará ARIA grave o potencialmente mortal? ¿En qué momento ARIA pasa de inofensivo a perjudicial y cuándo se debe suspender el tratamiento con lecanemab?
Muchas de las mismas preguntas sobre beneficios y riesgos también se aplican a otro anticuerpo que elimina el amiloide, el donanemab, fabricado por Eli Lilly en Indianápolis, Indiana, que fue aprobado por la FDA en julio. Donanemab parece proporcionar aproximadamente la misma reducción en el deterioro cognitivo que lecanamab y se ha relacionado con muertes relacionadas con ARIA.
"Sabemos por el trabajo con biomarcadores que estos anticuerpos eliminan el amiloide, por lo que sabemos que abordan un mecanismo fundamental de la enfermedad", dice Malhotra. Pero estos medicamentos por sí solos probablemente no serán suficientes y será importante abordar también otros aspectos de la enfermedad. "Es muy probable que dentro de 10 años estemos hablando de terapias combinadas y que la eliminación de amiloide sea parte de ese enfoque".

 Suche
Suche
 Mein Konto
Mein Konto