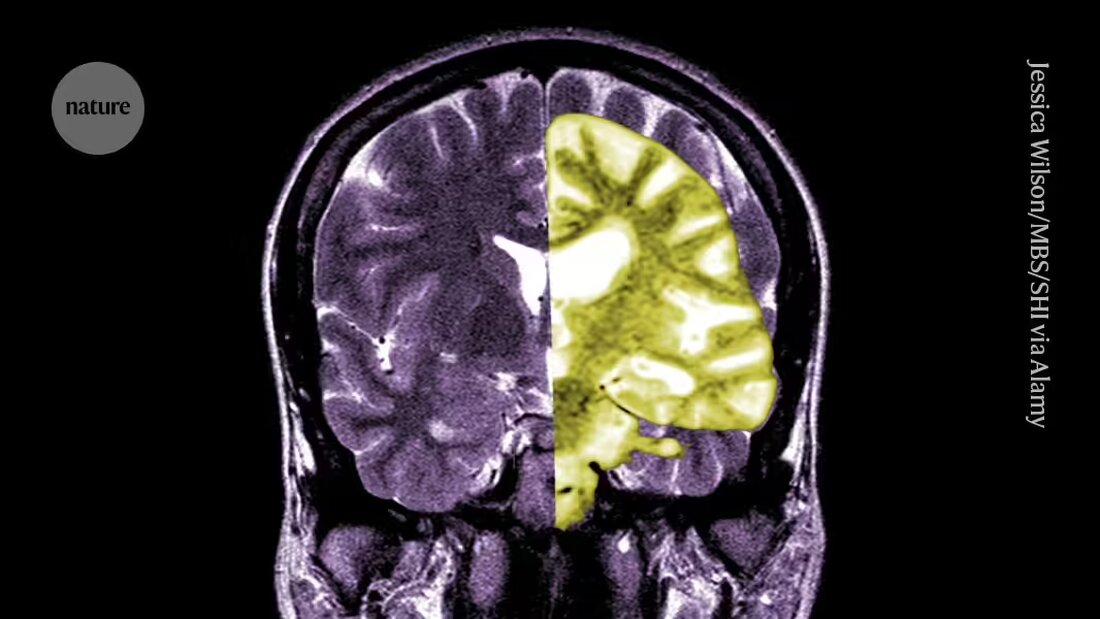
Debatten om Alzheimers lægemiddel lecanemab - en af de første lægemidler til at bremse kognitiv tilbagegang hos mennesker - intensiveres blandt forskere og klinikere om, hvorvidt behandlingens potentielle fordele opvejer dens risici.
Den 22. august gav Storbritanniens Medicines and Healthcare products Regulatory Agency stoffet grønt lys. Samtidig sagde Storbritanniens sundhedstilsynsmyndighed NICE, som afgør, om lægemidler tilbydes patienter på Storbritanniens statsfinansierede National Health Service (NHS), i et udkast, at lecanemab ikke ville blive gjort tilgængeligt på NHS, fordi fordelene var for små til at retfærdiggøre de høje omkostninger.
"Den usædvanligt lange tid, de brugte på at gennemgå stoffet, tyder på, at dette ikke var en nem eller simpel beslutning," sagde psykiater Robert Howard fra University College London i en erklæring til Science Media Center i Storbritannien.
Amerikanske regulatorer var de første til at godkende lægemidlet i 2023, og det europæiske lægemiddelagentur (EMA) gennemgår nu sin beslutning efter en appel fra lægemiddelproducenten.
Amyloid mål
EMA's beslutning fik også blandede reaktioner fra Alzheimers samfund. "Følelserne kører virkelig højt her," siger biokemiker Christian Haass fra Ludwig Maximilians Universitet i München, Tyskland, som er uenig i beslutningen. "Det er det første sygdomsmodificerende lægemiddel, vi har haft i mere end 30 år." At nægte patienter adgang til lecanemab betyder, at mange mister muligheden for at få værdifuld tid, ifølge Haass.
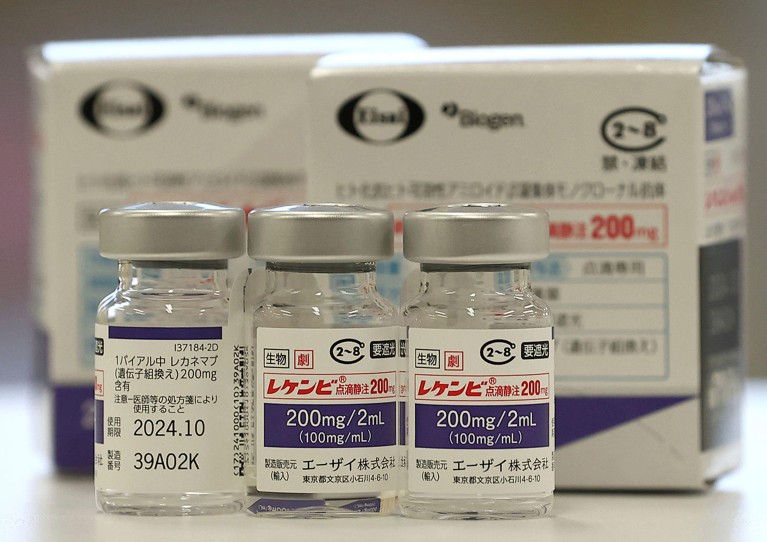
Lecanemab, eller Leqembi, er et monoklonalt antistof, der eliminerer amyloid, et stof, der opbygges til giftige klumper i hjernen hos mennesker med Alzheimers. Lægemidlet, der er fremstillet af Eisai i Tokyo og Biogen i Cambridge, Massachusetts, er også godkendt i Kina, Japan, Sydkorea og De Forenede Arabiske Emirater.
Andre bifalder EMA og siger, at selvom lægemidlet har været effektivt til at reducere amyloidniveauer i hjernen, er det stadig uklart, om den resulterende reduktion i kognitiv tilbagegang vil resultere i klinisk relevante fordele for patienterne. De anfører, at muligheden for alvorlige komplikationer såsom blødning eller hævelse i hjernen forårsaget af en bivirkning kaldet amyloid-relaterede billeddannelseseffekter (ARIA), selvom den er lille, er en stor bekymring. "En rimelig vurdering af risiciene kontra fordelene ved dette lægemiddel burde få folk til at være meget skeptiske," siger Matthew Schrag, en neurolog ved Vanderbilt University i Nashville, Tennessee.
Beskedne effekter
Hvorvidt lecanemab administreret ved infusion giver mennesker klinisk betydningsfulde reduktioner i kognitiv tilbagegang har længe været diskuteret.
Et klinisk fase III-forsøg med lægemidlet, offentliggjort i 2022, omfattede 1.795 personer i de tidlige stadier af Alzheimers sygdom og fandt ud af, at de, der fik lægemidlet, viste en 27 % reduktion i kognitivt fald efter 18 måneder sammenlignet med dem, der fik placebo. Nogle forskere fejrede nyheden som en sejr for feltet. Men andre hævdede, at virkningerne er for små til at have en meningsfuld indvirkning på patienterne.
En af grundene til denne forskel i perspektiv er, hvordan folk ser på dataene, siger Sebastian Walsh, en folkesundhedsforsker ved University of Cambridge, Storbritannien. Reduktionen på 27 % repræsenterer den relative forskel i mængden af kognitiv tilbagegang oplevet af lægemiddelgruppen sammenlignet med placebogruppen. Den absolutte forskel i kognitiv funktion er dog meget mindre: 0,45 point på en 18-punkts skala. "Folk kan udtrække, hvad de vil, fra effektstørrelsen," siger Walsh. "Hvis de vil sælge stoffet, kan de fokusere på relative ændringer - og hvis de er meget skeptiske, kan de tale om de absolutte forskelle."
Men selv små effekter kan blive betydelige over tid, især i de senere stadier af sygdommen, når nedbrydningen sker hurtigere, siger Walsh. "I sidste ende afhænger det af, hvad du tror, hvad den langsigtede effekt vil være, og det har vi ikke et svar på."
Nogle langsigtede data er nu tilgængelige. Ved Alzheimer Association International Conference (AAIC) i Philadelphia i sidste måned præsenterede Eisai og Biogen resultater fra et åbent forlængelsesstudie, der fortsatte med at overvåge patienter, der fik lecanemab efter afslutningen af fase III-studiet. Efter tre års kontinuerlig behandling viste mere end halvdelen af patienterne bedring, og de fleste tilfælde af ARIA forekom i de første seks måneder af behandlingen. De rapporterede også, at hastigheden af kognitiv tilbagegang vendte tilbage til placebo-niveauer, når folk holdt op med at tage stoffet, selvom amyloidplakkerne var blevet fjernet, før behandlingen blev stoppet.
Nogle er optimistiske med hensyn til disse resultater - Haass siger, at det er spændende at se, at stoffet ikke kun eliminerer amyloid, men også bremser spredningen af tau, et andet protein, der opbygges til klumper i hjernen hos mennesker med Alzheimers. Andre er mere forsigtige. Paresh Malhotra, en neurolog ved Imperial College London, påpeger, at de positive resultater, der blev præsenteret på AAIC, ikke blev sammenlignet med en placebo, så flere data er nødvendige for at bestemme lægemidlets langsigtede effektivitet.
Omkostninger er også en bekymring. Walsh siger, at givet lægemidlets beskedne virkninger, er det svært at retfærdiggøre omkostningerne ved at administrere lægemidlet (som koster mere end $20.000 om året i USA) og de nødvendige procedurer, såsom billeddannelse og genetisk testning, for at identificere berettigede personer til at modtage det.
Sikkerhedsproblemer
Den største bekymring med lecanemab er ARIA, som US Food and Drug Administration (FDA) advarede om i sin godkendelse. Selvom de fleste tilfælde er asymptomatiske - og ingen blev rapporteret under det indledende 18-måneders kliniske forsøg - var der nogle ARIA-relaterede dødsfald i den udvidede fase af undersøgelsen.
Nogle eksperter siger, at selvom risikoen for svær ARIA er lav, er det også vigtigt at overveje, at lægemidlet gives i de tidligste stadier af Alzheimers. "Dette er den periode, hvor folk har mest at tabe," siger Schrag. "I løbet af dette vindue opfordrer vi ofte patienter til at rejse, tænke på deres bucket list og opnå de ting, de ønsker at opnå i livet."
Ellis van Etten, neurolog ved Leiden University Medical Center i Holland, siger, at der stadig er mange ubesvarede spørgsmål om ARIA, og hvordan læger skal reagere, når de ser patienter udvikle disse abnormiteter under behandlingen. For eksempel: Hvem vil udvikle alvorlig eller livstruende ARIA? På hvilket tidspunkt går ARIA fra harmløs til skadelig, og hvornår skal behandlingen med lecanemab stoppes?
Mange af de samme spørgsmål om fordele og risici gælder også for et andet amyloid-clearing antistof, donanemab - lavet af Eli Lilly i Indianapolis, Indiana - som blev godkendt af FDA i juli. Donanemab ser ud til at give omtrent samme reduktion i kognitiv tilbagegang som lecanamab - og det er blevet forbundet med ARIA-relaterede dødsfald.
"Vi ved fra biomarkørarbejde, at disse antistoffer renser amyloid, så vi ved, at de adresserer en grundlæggende mekanisme ved sygdommen," siger Malhotra. Men disse medikamenter alene vil sandsynligvis ikke være nok, og det vil være vigtigt at behandle andre aspekter af sygdommen også. "Det er meget sandsynligt, at vi om 10 år vil tale om kombinationsterapier, og at amyloid-clearance vil være en del af den tilgang."

 Suche
Suche
 Mein Konto
Mein Konto