Debata o léku na Alzheimerovu chorobu lecanemab – jednom z prvních léků, který zpomaluje kognitivní úpadek u lidí – se mezi výzkumníky a lékaři zintenzivňuje o tom, zda potenciální přínosy léčby převažují nad jejími riziky.
22. srpna dala léku zelenou britská agentura pro regulaci léčiv a zdravotních produktů. Zároveň však britský zdravotnický regulátor NICE, který určuje, zda jsou léky nabízeny pacientům v britské státem financované National Health Service (NHS), v návrhu uvedl, že lecanemab nebude zpřístupněn NHS, protože přínosy byly příliš malé na to, aby ospravedlnily vysoké náklady.
"Neobvykle dlouhá doba, kterou strávili přezkoumáním léku, naznačuje, že to nebylo snadné nebo jednoduché rozhodnutí," řekl psychiatr Robert Howard z University College London v prohlášení pro Science Media Center v Británii.
Američtí regulátoři byli první, kdo lék schválil v roce 2023, a Evropská léková agentura (EMA) nyní po odvolání výrobce léků přezkoumává jeho rozhodnutí.
Amyloidní cíl
Rozhodnutí EMA také vyvolalo smíšené reakce od Alzheimerovy komunity. „Emoce tady opravdu bouří,“ říká biochemik Christian Haass z Univerzity Ludwiga Maximilianse v Mnichově, který s rozhodnutím nesouhlasí. "Je to první lék modifikující onemocnění, který jsme měli za více než 30 let." Odepření přístupu pacientů k lecanemabu znamená, že mnozí ztrácejí příležitost získat drahocenný čas, tvrdí Haass.
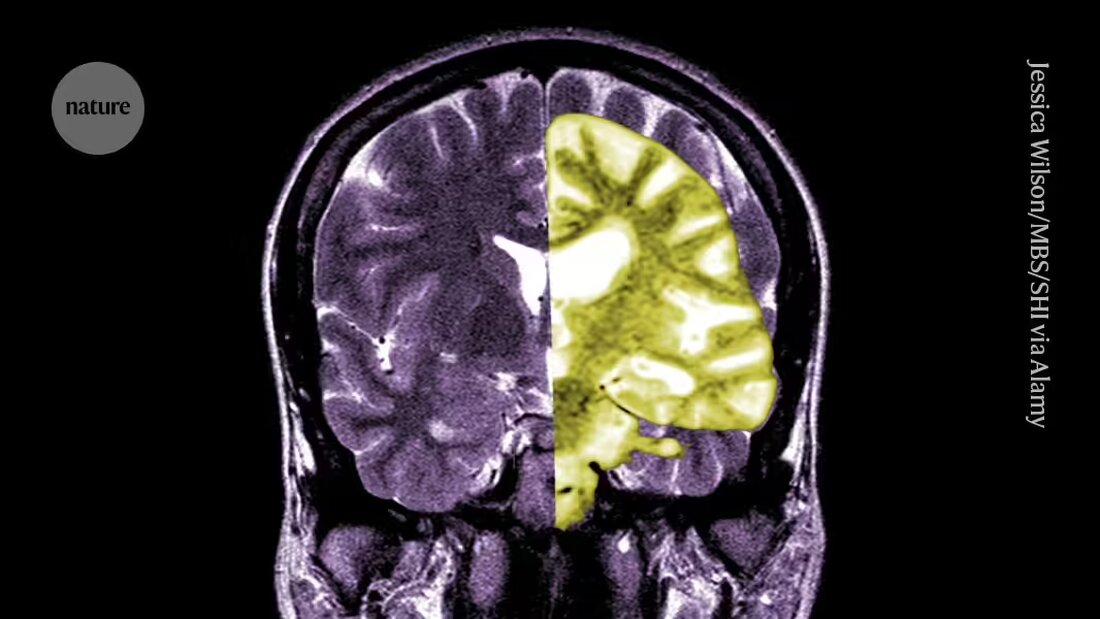
Lecanemab nebo Leqembi je monoklonální protilátka, která eliminuje amyloid, látku, která se ukládá do toxických shluků v mozcích lidí s Alzheimerovou chorobou. Lék, který vyrábí Eisai v Tokiu a Biogen v Cambridge, Massachusetts, je schválen také v Číně, Japonsku, Jižní Koreji a Spojených arabských emirátech.
Jiní tleskají EMA a říkají, že i když byl lék účinný při snižování hladiny amyloidu v mozku, zůstává nejasné, zda výsledné snížení kognitivního poklesu povede ke klinicky relevantním přínosům pro pacienty. Uvádějí, že možnost závažných komplikací, jako je krvácení nebo otok v mozku způsobená vedlejším účinkem nazývaným amyloid-related imaging effects (ARIA), i když je malá, je velkým problémem. "Rozumné posouzení rizik versus přínosů tohoto léku by mělo vést lidi k velké skepsi," říká Matthew Schrag, neurolog z Vanderbilt University v Nashvillu, Tennessee.
Skromné efekty
Dlouho se diskutuje o tom, zda lecanemab podávaný infuzí poskytuje lidem klinicky významné snížení kognitivního poklesu.
Klinická studie fáze III tohoto léku, publikovaná v roce 2022, zahrnovala 1 795 lidí v raných stádiích Alzheimerovy choroby a zjistila, že ti, kteří dostávali lék, vykazovali 27% snížení kognitivního poklesu po 18 měsících ve srovnání s těmi, kteří dostávali placebo. Někteří badatelé tuto zprávu oslavovali jako vítězství oboru. Jiní však tvrdili, že účinky jsou příliš malé na to, aby měly významný dopad na pacienty.
Jedním z důvodů tohoto rozdílu v pohledu je to, jak se lidé dívají na data, říká Sebastian Walsh, výzkumník v oblasti veřejného zdraví na University of Cambridge ve Velké Británii. Snížení o 27 % představuje relativní rozdíl v míře poklesu kognitivních funkcí u skupiny s léčivem ve srovnání se skupinou s placebem. Absolutní rozdíl v kognitivních funkcích je však mnohem menší: 0,45 bodu na 18bodové škále. „Lidé mohou z velikosti efektu vytěžit, co chtějí,“ říká Walsh. "Pokud chtějí drogu prodat, mohli by se zaměřit na relativní změny - a pokud jsou velmi skeptičtí, mohli by mluvit o absolutních rozdílech."
Ale i malé účinky se mohou časem stát významnými, zejména v pozdějších fázích onemocnění, kdy dochází k degradaci rychleji, říká Walsh. "Nakonec záleží na tom, co si myslíte, jaký bude dlouhodobý dopad, a na to nemáme odpověď."
Nyní jsou k dispozici některá dlouhodobá data. Na mezinárodní konferenci Alzheimerovy asociace (AAIC) ve Philadelphii minulý měsíc Eisai a Biogen prezentovali výsledky otevřené rozšířené studie, která pokračovala v monitorování pacientů, kteří dostávali lecanemab po dokončení studie fáze III. Po třech letech nepřetržité léčby více než polovina pacientů vykazovala zlepšení a většina případů ARIA se objevila v prvních šesti měsících léčby. Také uvedli, že míra poklesu kognitivních funkcí se vrátila na úroveň placeba, když lidé přestali užívat lék, i když byly amyloidní plaky odstraněny před ukončením léčby.
Někteří jsou ohledně těchto výsledků optimističtí – Haass říká, že je vzrušující vidět, že lék nejen eliminuje amyloid, ale také zpomaluje šíření tau, dalšího proteinu, který se ukládá do shluků v mozcích lidí s Alzheimerovou chorobou. Ostatní jsou opatrnější. Paresh Malhotra, neurolog z Imperial College London, poukazuje na to, že pozitivní výsledky prezentované na AAIC nebyly srovnávány s placebem, takže k určení dlouhodobé účinnosti léku je zapotřebí více údajů.
Obavy jsou také náklady. Walsh říká, že vzhledem k mírným účinkům léku je obtížné ospravedlnit náklady na podávání léku (které v USA stojí více než 20 000 dolarů ročně) a postupy, které jsou nutné, jako je zobrazování a genetické testování, k identifikaci způsobilých osob, které jej obdrží.
Obavy o bezpečnost
Největší starost s lecanemabem je ARIA, na kterou ve svém schválení varoval americký Úřad pro kontrolu potravin a léčiv (FDA). Ačkoli většina případů je asymptomatická – a žádný nebyl hlášen během počáteční 18měsíční klinické studie – v prodloužené fázi studie došlo k některým úmrtím souvisejícím s ARIA.
Někteří odborníci tvrdí, že ačkoli je riziko těžké ARI nízké, je také důležité vzít v úvahu, že lék je podáván v nejranějších stádiích Alzheimerovy choroby. „Toto je období, kdy lidé mohou nejvíce ztratit,“ říká Schrag. "Během tohoto okna často povzbuzujeme pacienty, aby cestovali, přemýšleli o svém seznamu a dosáhli věcí, kterých chtějí v životě dosáhnout."
Ellis van Etten, neurolog z Leiden University Medical Center v Nizozemsku, říká, že stále existuje mnoho nezodpovězených otázek ohledně ARIA a toho, jak by lékaři měli reagovat, když vidí, že se u pacientů během léčby rozvinou tyto abnormality. Například: U koho se rozvine vážná nebo život ohrožující ARI? V jakém bodě se ARIA mění z neškodné na škodlivou a kdy by měla být léčba lecanemabem ukončena?
Mnoho stejných otázek o výhodách a rizicích se vztahuje také na jinou protilátku odstraňující amyloid, donanemab – vyrobenou Eli Lilly v Indianapolis, Indiana – která byla schválena FDA v červenci. Zdá se, že donanemab poskytuje přibližně stejné snížení kognitivního poklesu jako lecanamab – a je spojován s úmrtími souvisejícími s ARIA.
"Z práce biomarkerů víme, že tyto protilátky odstraňují amyloid, takže víme, že řeší základní mechanismus onemocnění," říká Malhotra. Ale tyto léky samy o sobě pravděpodobně stačit nebudou a bude důležité řešit i další aspekty nemoci. "Je velmi pravděpodobné, že za 10 let budeme mluvit o kombinovaných terapiích a že clearance amyloidu bude součástí tohoto přístupu."

 Suche
Suche
 Mein Konto
Mein Konto