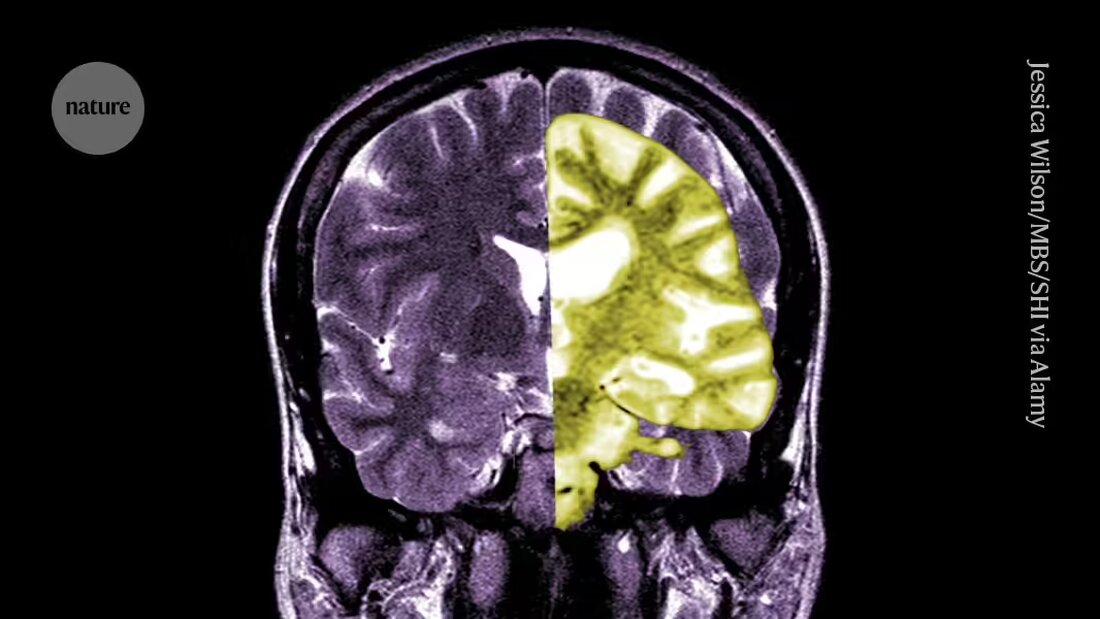
Дебатът относно лекарството за Алцхаймер леканемаб - едно от първите лекарства за забавяне на когнитивния спад при хората - се засилва сред изследователи и клиницисти относно това дали потенциалните ползи от лечението надвишават рисковете.
На 22 август Британската агенция за регулиране на лекарствата и здравните продукти даде зелена светлина на лекарството. В същото време обаче британският здравен регулатор NICE, който определя дали лекарствата се предлагат на пациентите от финансираната от държавата Национална здравна служба (NHS) на Великобритания, каза в проект, че леканемаб няма да бъде предоставен на NHS, тъй като ползите са твърде малки, за да оправдаят високата цена.
„Необичайно дългото време, което са прекарали в преглед на лекарството, предполага, че това не е било лесно или просто решение“, каза психиатърът Робърт Хауърд от Лондонския университетски колеж в изявление за Science Media Center във Великобритания.
Американските регулатори бяха първите, които одобриха лекарството през 2023 г., а Европейската агенция по лекарствата (EMA) сега преразглежда решението си след обжалване от страна на производителя на лекарства.
Амилоидна цел
Решението на EMA също получи смесени реакции от общността на Алцхаймер. „Емоциите наистина са нагорещени тук“, казва биохимикът Кристиан Хаас от университета „Лудвиг Максимилиан“ в Мюнхен, Германия, който не е съгласен с решението. „Това е първото лекарство, модифициращо заболяването, което имаме от повече от 30 години.“ Отказването на достъп на пациентите до леканемаб означава, че мнозина губят възможността да спечелят ценно време, според Хаас.
Lecanemab или Leqembi е моноклонално антитяло, което елиминира амилоида, вещество, което се натрупва в токсични бучки в мозъците на хора с Алцхаймер. Лекарството, произведено от Eisai в Токио и Biogen в Кеймбридж, Масачузетс, е одобрено и в Китай, Япония, Южна Корея и Обединените арабски емирства.
Други аплодират EMA, като казват, че въпреки че лекарството е ефективно за намаляване на нивата на амилоид в мозъка, остава неясно дали полученото намаляване на когнитивния спад ще доведе до клинично значими ползи за пациентите. Те заявяват, че възможността за сериозни усложнения като кървене или подуване в мозъка, причинени от страничен ефект, наречен амилоид-свързани образни ефекти (ARIA), макар и малка, е сериозна загриженост. „Разумната оценка на рисковете спрямо ползите от това лекарство трябва да накара хората да бъдат много скептични“, казва Матю Шраг, невролог от университета Вандербилт в Нешвил, Тенеси.
Скромни ефекти
Дали леканемаб, прилаган чрез инфузия, осигурява на хората клинично значимо намаляване на когнитивния спад, отдавна се обсъжда.
Клинично изпитване от фаза III на лекарството, публикувано през 2022 г., включва 1795 души в ранните стадии на болестта на Алцхаймер и установява, че тези, които са получавали лекарството, показват 27% намаление на когнитивния спад след 18 месеца в сравнение с тези, които са получавали плацебо. Някои изследователи отпразнуваха новината като победа за полето. Други обаче твърдят, че ефектите са твърде малки, за да имат значимо въздействие върху пациентите.
Една от причините за тази разлика в перспективата е как хората гледат на данните, казва Себастиан Уолш, изследовател на общественото здраве в университета в Кеймбридж, Обединеното кралство. Намалението от 27% представлява относителната разлика в степента на когнитивен спад, изпитан от групата на лекарството в сравнение с групата на плацебо. Въпреки това, абсолютната разлика в когнитивната функция е много по-малка: 0,45 точки по 18-степенна скала. „Хората могат да извлекат каквото искат от размера на ефекта“, казва Уолш. „Ако искат да продадат лекарството, биха могли да се съсредоточат върху относителните промени – и ако са много скептични, биха могли да говорят за абсолютните разлики.“
Но дори малки ефекти могат да станат значителни с течение на времето, особено в по-късните стадии на заболяването, когато разграждането настъпва по-бързо, казва Уолш. „В крайна сметка зависи от това какво мислите какво ще бъде дългосрочното въздействие и ние нямаме отговор на това.“
Вече са налични някои дългосрочни данни. На Международната конференция на асоциацията на Алцхаймер (AAIC) във Филаделфия миналия месец Eisai и Biogen представиха резултати от отворено разширено проучване, което продължи да наблюдава пациентите, получавали леканемаб след завършване на изпитването фаза III. След три години непрекъснато лечение повече от половината от пациентите показват подобрение и повечето случаи на ARIA се появяват през първите шест месеца от лечението. Те също така съобщават, че степента на когнитивен спад се връща до нивата на плацебо, когато хората спрат да приемат лекарството, дори ако амилоидните плаки са били отстранени преди лечението да бъде спряно.
Някои са оптимисти за тези резултати - Хаас казва, че е вълнуващо да се види, че лекарството не само елиминира амилоида, но също така забавя разпространението на тау, друг протеин, който се натрупва в бучки в мозъците на хора с Алцхаймер. Други са по-предпазливи. Пареш Малхотра, невролог от Imperial College London, посочва, че положителните резултати, представени в AAIC, не са сравнени с плацебо, така че са необходими повече данни, за да се определи дългосрочната ефективност на лекарството.
Цената също е проблем. Уолш казва, че като се имат предвид скромните ефекти на лекарството, е трудно да се оправдаят разходите за прилагане на лекарството (което струва повече от 20 000 долара годишно в САЩ) и необходимите процедури, като образна диагностика и генетично изследване, за идентифициране на отговарящите на условията хора да го получат.
Съображения за безопасност
Най-голямото безпокойство с леканемаб е ARIA, за което Американската администрация по храните и лекарствата (FDA) предупреди в своето одобрение. Въпреки че повечето случаи са асимптоматични - и нито един не е докладван по време на първоначалното 18-месечно клинично изпитване - имаше някои смъртни случаи, свързани с ARIA, в разширената фаза на проучването.
Някои експерти казват, че въпреки че рискът от тежка ARIA е нисък, също така е важно да се има предвид, че лекарството се прилага в най-ранните стадии на Алцхаймер. „Това е периодът, в който хората могат да загубят най-много“, казва Шраг. „По време на този прозорец ние често насърчаваме пациентите да пътуват, да мислят за своя списък с кофи и да постигнат нещата, които искат да постигнат в живота.“
Елис ван Етен, невролог в Медицинския център на университета Лайден в Холандия, казва, че все още има много въпроси без отговор относно ARIA и как трябва да реагират лекарите, когато видят пациенти, развиващи тези аномалии по време на лечението. Например: Кой ще развие сериозна или животозастрашаваща ARIA? В кой момент ARIA преминава от безвреден във вреден и кога трябва да се спре лечението с леканемаб?
Много от същите въпроси относно ползите и рисковете се отнасят и за друго антитяло за изчистване на амилоид, донанемаб - направено от Eli Lilly в Индианаполис, Индиана - което беше одобрено от FDA през юли. Изглежда, че донанемаб осигурява приблизително същото намаляване на когнитивния спад като леканамаб – и е свързан със смъртни случаи, свързани с ARIA.
„Ние знаем от работата с биомаркери, че тези антитела изчистват амилоида, така че знаем, че те са насочени към основен механизъм на заболяването“, казва Малхотра. Но тези лекарства сами по себе си вероятно няма да са достатъчни и ще бъде важно да се обърне внимание и на други аспекти на болестта. „Много вероятно е след 10 години да говорим за комбинирани терапии и изчистването на амилоида да бъде част от този подход.“

 Suche
Suche
 Mein Konto
Mein Konto