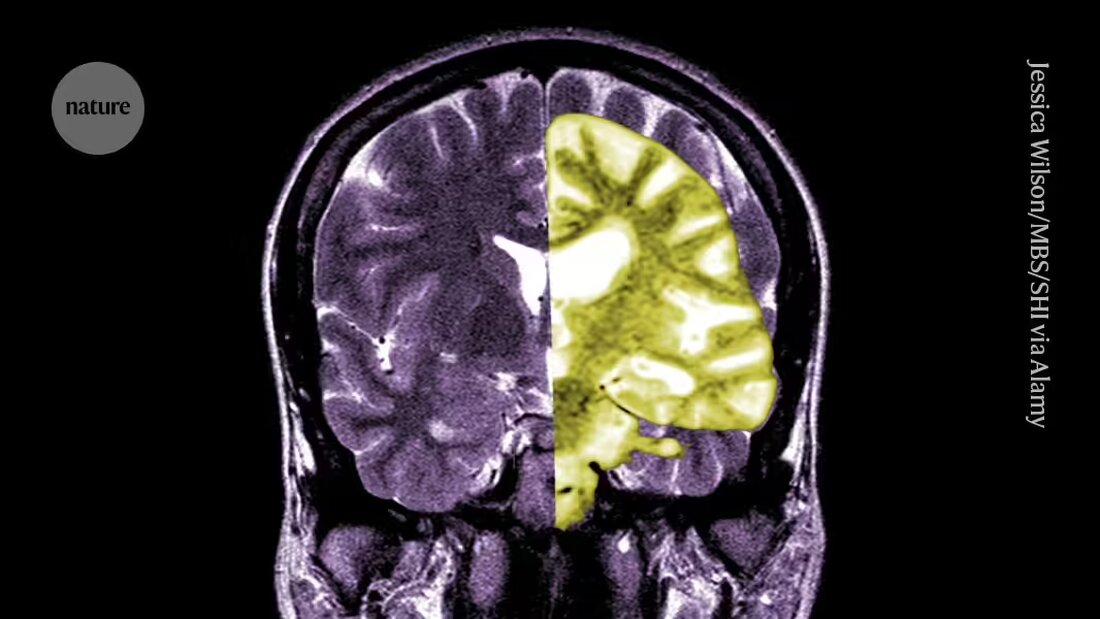
يتزايد الجدل حول عقار الزهايمر ليكانيماب - وهو أحد الأدوية الأولى التي تبطئ التدهور المعرفي لدى البشر - بين الباحثين والأطباء حول ما إذا كانت الفوائد المحتملة للعلاج تفوق مخاطره.
وفي 22 أغسطس، أعطت وكالة تنظيم الأدوية ومنتجات الرعاية الصحية البريطانية الضوء الأخضر للدواء. ومع ذلك، في الوقت نفسه، قالت هيئة تنظيم الصحة البريطانية NICE، التي تحدد ما إذا كانت الأدوية تقدم للمرضى في خدمة الصحة الوطنية التي تمولها الدولة في بريطانيا، في مسودة إن عقار ليكانيماب لن يكون متاحًا في هيئة الخدمات الصحية الوطنية لأن الفوائد كانت صغيرة جدًا بحيث لا تبرر التكلفة المرتفعة.
وقال الطبيب النفسي روبرت هوارد من جامعة كوليدج لندن في تصريح لمركز الإعلام العلمي في بريطانيا: "الوقت الطويل غير المعتاد الذي أمضاه في مراجعة الدواء يشير إلى أن هذا لم يكن قرارا سهلا أو بسيطا".
وكان المنظمون الأمريكيون أول من وافق على الدواء في عام 2023، وتقوم وكالة الأدوية الأوروبية (EMA) الآن بمراجعة قرارها بعد استئناف الشركة المصنعة للأدوية.
هدف الأميلويد
كما تلقى قرار وكالة الأدوية الأوروبية ردود فعل متباينة من مجتمع الزهايمر. يقول عالم الكيمياء الحيوية كريستيان هاس من جامعة لودفيغ ماكسيميليانز في ميونيخ بألمانيا، الذي لا يتفق مع القرار: "المشاعر متأججة حقًا هنا". "إنه أول دواء معدل للأمراض لدينا منذ أكثر من 30 عامًا." إن حرمان المرضى من الوصول إلى عقار "ليكانيماب" يعني خسارة الكثيرين لفرصة كسب وقت ثمين، وفقًا لهاس.
Lecanemab، أو Leqembi، هو جسم مضاد وحيد النسيلة يزيل الأميلويد، وهي مادة تتراكم في كتل سامة في أدمغة الأشخاص المصابين بمرض الزهايمر. الدواء، الذي صنعته شركة Eisai في طوكيو وBiogen في كامبريدج، ماساتشوستس، تمت الموافقة عليه أيضًا في الصين واليابان وكوريا الجنوبية والإمارات العربية المتحدة.
وأشاد آخرون بوكالة الأدوية الأوروبية، قائلين إنه على الرغم من أن الدواء كان فعالا في خفض مستويات الأميلويد في الدماغ، إلا أن ما إذا كان الانخفاض الناتج في التدهور المعرفي سيؤدي إلى فوائد ذات صلة سريريا للمرضى لا يزال غير واضح. ويذكرون أن احتمال حدوث مضاعفات خطيرة مثل النزيف أو التورم في الدماغ الناجم عن تأثير جانبي يسمى تأثيرات التصوير المرتبطة بالأميلويد (ARIA)، على الرغم من صغره، يعد مصدر قلق كبير. يقول ماثيو شراج، طبيب الأعصاب في جامعة فاندربيلت في ناشفيل، تينيسي: "إن التقييم المعقول للمخاطر مقابل فوائد هذا الدواء يجب أن يدفع الناس إلى أن يكونوا متشككين للغاية".
آثار متواضعة
ما إذا كان عقار الليكانيماب الذي يتم إعطاؤه عن طريق التسريب يوفر للأشخاص انخفاضًا ذا معنى سريريًا في التدهور المعرفي، فقد تمت مناقشة ذلك منذ فترة طويلة.
وشملت تجربة سريرية للمرحلة الثالثة للدواء، نُشرت في عام 2022، 1795 شخصًا في المراحل المبكرة من مرض الزهايمر، ووجدت أن أولئك الذين تلقوا الدواء أظهروا انخفاضًا بنسبة 27٪ في التدهور المعرفي بعد 18 شهرًا مقارنة بأولئك الذين تلقوا علاجًا وهميًا. واحتفل بعض الباحثين بالخبر باعتباره انتصارًا للمجال. ومع ذلك، يرى آخرون أن التأثيرات أصغر من أن يكون لها تأثير ملموس على المرضى.
يقول سيباستيان والش، الباحث في الصحة العامة بجامعة كامبريدج بالمملكة المتحدة، إن أحد أسباب هذا الاختلاف في المنظور هو الطريقة التي ينظر بها الناس إلى البيانات. ويمثل الانخفاض بنسبة 27% الفرق النسبي في مقدار التدهور المعرفي الذي تعاني منه مجموعة الدواء مقارنة بمجموعة الدواء الوهمي. ومع ذلك، فإن الفرق المطلق في الوظيفة الإدراكية أصغر بكثير: 0.45 نقطة على مقياس مكون من 18 نقطة. يقول والش: "يمكن للناس استخلاص ما يريدون من حجم التأثير". "إذا أرادوا بيع الدواء، فيمكنهم التركيز على التغيرات النسبية - وإذا كانوا متشككين للغاية، فيمكنهم التحدث عن الاختلافات المطلقة".
ولكن حتى التأثيرات الصغيرة يمكن أن تصبح كبيرة بمرور الوقت، خاصة في المراحل المتأخرة من المرض عندما يحدث التدهور بسرعة أكبر، كما يقول والش. "في نهاية المطاف، يعتمد الأمر على ما تعتقد أنه سيكون عليه التأثير على المدى الطويل، وليس لدينا إجابة لذلك".
بعض البيانات طويلة المدى متاحة الآن. في المؤتمر الدولي لجمعية الزهايمر (AAIC) في فيلادلفيا الشهر الماضي، قدم إيساي وبيوجين نتائج من دراسة تمديد مفتوحة التسمية استمرت في مراقبة المرضى الذين تلقوا ليكانيماب بعد الانتهاء من تجربة المرحلة الثالثة. وبعد ثلاث سنوات من العلاج المستمر، أظهر أكثر من نصف المرضى تحسنًا، وحدثت معظم حالات ARIA في الأشهر الستة الأولى من العلاج. وأفادوا أيضًا أن معدل التدهور المعرفي عاد إلى مستويات العلاج الوهمي عندما توقف الأشخاص عن تناول الدواء، حتى لو تمت إزالة لويحات الأميلويد قبل توقف العلاج.
البعض متفائل بشأن هذه النتائج، يقول هاس إنه من المثير أن نرى أن الدواء لا يزيل الأميلويد فحسب، بل يبطئ أيضًا انتشار بروتين تاو، وهو بروتين آخر يتراكم على شكل كتل في أدمغة الأشخاص المصابين بمرض الزهايمر. والبعض الآخر أكثر حذرا. ويشير باريش مالهوترا، طبيب الأعصاب في إمبريال كوليدج لندن، إلى أن النتائج الإيجابية المقدمة في AAIC لم تتم مقارنتها بالعلاج الوهمي، لذلك هناك حاجة إلى مزيد من البيانات لتحديد مدى فعالية الدواء على المدى الطويل.
التكلفة هي أيضا مصدر قلق. يقول والش إنه نظرًا لتأثيرات الدواء المتواضعة، فمن الصعب تبرير تكلفة إعطاء الدواء (التي تكلف أكثر من 20 ألف دولار سنويًا في الولايات المتحدة) والإجراءات المطلوبة، مثل التصوير والاختبارات الجينية، لتحديد الأشخاص المؤهلين لتلقيه.
مخاوف تتعلق بالسلامة
مصدر القلق الأكبر بشأن دواء lecanemab هو ARIA، الذي حذرت منه إدارة الغذاء والدواء الأمريكية (FDA) في موافقتها. على الرغم من أن معظم الحالات بدون أعراض - ولم يتم الإبلاغ عن أي منها خلال التجربة السريرية الأولية التي استمرت 18 شهرًا - فقد كانت هناك بعض الوفيات المرتبطة بـ ARIA في المرحلة الممتدة من الدراسة.
يقول بعض الخبراء إنه على الرغم من انخفاض خطر الإصابة بـ ARIA الشديد، فمن المهم أيضًا مراعاة أن الدواء يُعطى في المراحل المبكرة من مرض الزهايمر. يقول شراج: "هذه هي الفترة التي يكون فيها الناس أكثر ما يخسرونه". "خلال هذه الفترة، غالبًا ما نشجع المرضى على السفر والتفكير في قائمة أمنياتهم وإنجاز الأشياء التي يريدون تحقيقها في الحياة."
يقول إليس فان إيتن، طبيب الأعصاب في المركز الطبي بجامعة ليدن في هولندا، إنه لا يزال هناك العديد من الأسئلة التي لم تتم الإجابة عليها حول ARIA وكيف يجب أن يستجيب الأطباء عندما يرون المرضى يصابون بهذه التشوهات أثناء العلاج. على سبيل المثال: من سيتطور إلى ARIA خطير أو مهدد للحياة؟ في أي مرحلة يتحول ARIA من غير ضار إلى ضار ومتى يجب إيقاف علاج الليكانيماب؟
العديد من الأسئلة نفسها حول الفوائد والمخاطر تنطبق أيضًا على جسم مضاد آخر لإزالة الأميلويد، وهو دونانيماب - الذي صنعته شركة إيلي ليلي في إنديانابوليس بولاية إنديانا - والذي وافقت عليه إدارة الغذاء والدواء في يوليو. يبدو أن عقار دونانيماب يقدم نفس التخفيض في التدهور المعرفي الذي يوفره عقار ليكاناماب - وقد تم ربطه بالوفيات المرتبطة بـ ARIA.
يقول مالهوترا: "نعلم من خلال عمل العلامات الحيوية أن هذه الأجسام المضادة تزيل الأميلويد، لذلك نعلم أنها تعالج الآلية الأساسية للمرض". لكن هذه الأدوية وحدها ربما لن تكون كافية، وسيكون من المهم معالجة جوانب أخرى من المرض أيضًا. "من المحتمل جدًا أننا سنتحدث خلال 10 سنوات عن العلاجات المركبة وأن إزالة الأميلويد ستكون جزءًا من هذا النهج."

 Suche
Suche
 Mein Konto
Mein Konto