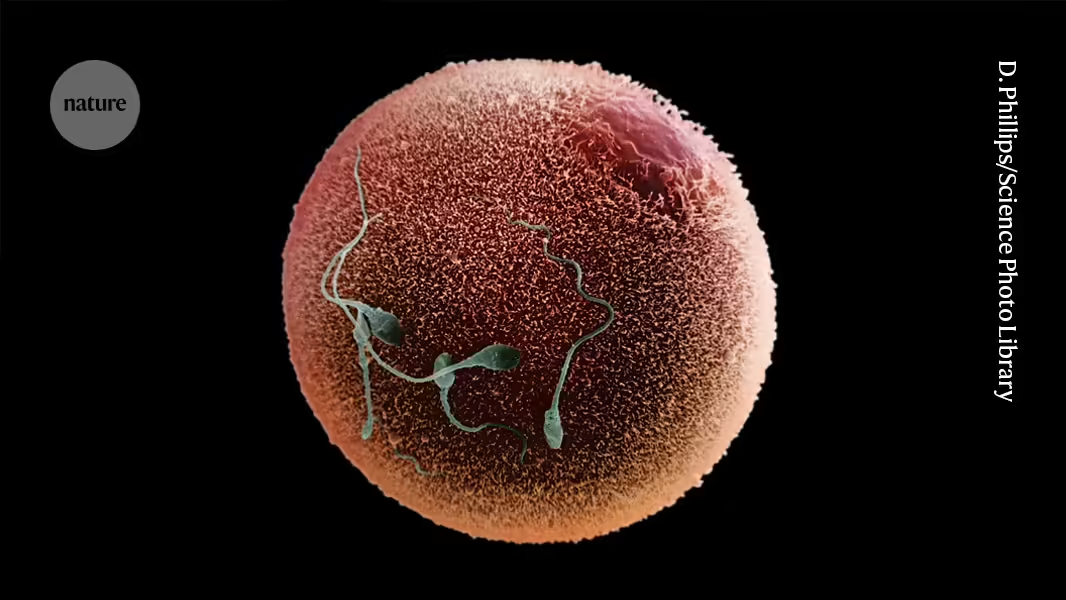
Ein künstliches Intelligenzwerkzeug, das in diesem Jahr mit dem Nobelpreis ausgezeichnet wurde, hat intime Details über die molekulare Begegnung zwischen Spermien und Eizellen1 enthüllt.
Das AlphaFold-Programm, das Proteinstrukturen vorhersagt, identifizierte ein Trio von Proteinen, die als Vermittler zwischen den Gameten fungieren. Ohne diese Proteine könnte die sexuelle Fortpflanzung in einer Vielzahl von Tieren, von Zebrafischen bis zu Säugetieren, ins Stocken geraten.
Die am 17. Oktober in Cell veröffentlichte Erkenntnis macht die frühere Annahme zunichte, dass nur zwei Proteine – eines auf der Eizelle und eines auf dem Spermium – ausreichend wären, um die Befruchtung sicherzustellen, sagt Enrica Bianchi, eine Fortpflanzungsbiologin an der Universität Rom „Tor Vergata“, die nicht an der Studie beteiligt war. „Es ist nicht mehr das alte Konzept, einen Schlüssel und ein Schloss zu haben, um die Tür zu öffnen,“ sagt sie. „Es ist komplizierter geworden.“
Eine geheimnisvolle Vereinigung
Trotz ihrer entscheidenden Rolle in der Fortpflanzung ist die Fusion von Ei- und Samenzelle bei Wirbeltieren ein molekularer Rätsel, das sich als schwierig zu entschlüsseln erwiesen hat. Die Verbindung der beiden Zellen beinhaltet Proteine, die in fettigen Membranen sitzen und schwer mit gängigen biochemischen Methoden zu untersuchen sind. Die Wechselwirkungen zwischen diesen Proteinen sind oft schwach und flüchtig, und es ist schwierig, genügend Eizellen und Spermien von einigen der bevorzugten Labor-Tiere, einschließlich Mäusen, für umfangreiche Experimente zu sammeln.
Aus diesem Grund konzentrierten sich frühe Studien zur Fortpflanzungsbiologie oft auf marine Wirbellose, die große Mengen an Eiern und Spermien ins Wasser abgeben. „Wenn Sie ein Lehrbuch nehmen und nach Befruchtung suchen, werden Sie alles über Seeigel lesen“, sagt Gavin Wright, ein Biochemiker an der Universität York, UK, der nicht an der Studie beteiligt war. „Es ist eine knifflige Sache, die zu erforschen.”
Um das Versorgungsproblem zu überwinden, begannen Andrea Pauli, eine Molekularbiologin am Forschungsinstitut für Molekulare Pathologie in Wien, und ihre Kollegen, ihre Arbeit an Zebrafischen, einer Wirbeltierart, die ebenfalls ihre Eier und Spermien ins umliegende Wasser abgibt. Um die Schwierigkeiten bei der Arbeit mit Membranproteinen im Labor zu umgehen, nutzte das Team AlphaFold, um die Wechselwirkungen zwischen Proteinen vorherzusagen. Zwei der Entwickler von AlphaFold erhielten am 9. Oktober den Nobelpreis für Chemie.
Nicht zwei, sondern drei
AlphaFold sagte voraus, dass drei Spermienproteine zusammenarbeiten, um einen Komplex zu bilden. Zwei dieser Proteine waren zuvor als wichtig für die Fruchtbarkeit bekannt. Pauli und ihre Kollegen bestätigten dann, dass das dritte ebenfalls entscheidend für die Fruchtbarkeit sowohl bei Zebrafischen als auch bei Mäusen ist und dass die drei Proteine miteinander interagieren.
Das Team stellte außerdem fest, dass die Dreiergruppe bei Zebrafischen einen Platz schafft, an den ein Ei-Protein binden kann, was einen Mechanismus bietet, durch den sich die beiden Zellen gegenseitig erkennen können. „Es ist eine Art zu sagen: ‚Spermium, du hast ein Ei gefunden‘ und ‚Ei, du hast ein Spermium gefunden’“, sagt Andreas Blaha, ein Biochemiker am Forschungsinstitut für Molekulare Pathologie und Mitautor der Studie.
Die Ergebnisse könnten eines Tages eine Möglichkeit bieten, Menschen mit Unfruchtbarkeit zu screenen, um herauszufinden, ob Probleme mit diesem Komplex die Ursache sein könnten, sagt Wright.
Die Ergebnisse heben auch die Rolle von AlphaFold bei der Untersuchung der Befruchtung hervor, fügt er hinzu. „Wir sind in Bezug auf Experimente eingeschränkt“, sagt er. „Es könnte sein, dass diese Modellergebnisse in Zukunft eine wichtige Rolle spielen.”
-
Deneke, V. E., et al. Cell https://www.cell.com/cell/fulltext/S0092-8674(24)01093-6 (2024).